命名“Dynamic partitioning” 膜タンパク質が局在化するしくみを解明
「自発的な対称性の破れ」を通した生命機能原理の解明へ
研究成果のポイント
- 膜タンパク質の自己組織化による非対称局在形成の新規メカニズムを発見
- 1分子イメージング技術によって細胞膜の場所による膜タンパク質の拡散の違いを明らかに
- 細胞の極性や運動の異常が関与する疾患に対する理解の深化や新規治療法の開発に期待
概要
大阪大学大学院生命機能研究科の松岡里実助教、上村陽一郎招へい准教授、上田昌宏教授、米国ジョンズホプキンス大学のTatsat Banerjee、Peter N. Devreotes、 Pablo A. Iglesiasらの国際共同研究グループは、細胞膜上で膜タンパク質が前・後に偏って局在化する自己組織化のしくみを解明し、「dynamic partitioning」と命名しました(図1)。
運動する細胞では、様々な細胞内シグナル伝達分子が細胞膜上で前後に分かれて局在化して極性を形成することが知られています。こうした非対称局在について複数のメカニズムが提唱されていますが、貫通型膜タンパク質や脂質修飾によって細胞膜に結合する表在性膜タンパク質がどのように細胞膜上で非対称局在を形成するかはよく分かっていませんでした。
今回、研究グループは、細胞性粘菌と哺乳類培養細胞を用いて、脂質修飾を受ける表在性膜タンパク質である3種類の細胞内シグナル伝達分子を対象に、細胞膜局在の生細胞イメージング解析を行い、細胞膜上での側方拡散の速さの違いによって非対称局在を形成するメカニズム(dynamic partitioningと命名)を見出しました。今後、こうした「自発的な対称性の破れ」を通して多様な生命機能を実現する原理の解明につながる可能性があります。
本研究成果は、英国科学誌「Nature Communications」に、11月30日(木)に公開されました。
図1. 本研究で明らかにしたDynamic partitioningの模式図.
研究の背景
移動運動する細胞には前後方向の極性があります。細胞の前側で仮足が前方へ伸び、後ろ側が収縮することで細胞の移動が起こります。細胞の前・後でそれぞれ異なる細胞内シグナル伝達反応が活性化しており、前側で働くシグナル分子は前側に、後ろ側で働くシグナル分子は後ろ側に、それぞれ偏って細胞膜上に存在(非対称局在)します。前側の分子が局在する膜領域は、場所が固定されておらず、進行波が伝搬するように常に移動することが知られています。これは、細胞が方向転換をするために必要な性質で、神経細胞の活動電位の伝搬と同じく興奮系(excitable system)による自己組織化過程です。これまでの研究によって、後ろ側で働くシグナル分子は、前側の分子が局在するようになると細胞膜から解離して細胞質を拡散したのち前側の分子が局在していない細胞膜に結合することで後ろ側への非対称局在を形成するというモデルが提唱されています。しかし、貫通型膜タンパク質や脂質修飾を介して細胞膜に結合する表在性膜タンパク質も前後極性の形成において中心的なシグナル伝達反応に関与しており、こうした細胞膜から解離しない膜タンパク質が非対称局在を形成するメカニズムは未解明のままでした。
研究の内容
本研究グループは、まず、脂質修飾を介して細胞膜に結合する表在性膜タンパク質について調べました。タンパク質リン酸化酵素Akt/SGKのホモログであるPKBR1、ヘテロ3量体Gタンパク質βγサブユニット、低分子量Gタンパク質RasGは、いずれも細胞運動において重要な細胞内シグナル伝達分子であり、それぞれ脂質修飾されて細胞膜内葉に結合することが知られています。これらの膜タンパク質を前側膜領域のマーカーであるPI(3,4,5)P3と同時に顕微鏡観察したところ、細胞の後ろ側に局在化して進行波を形成することを見出しました。選択的光変換顕微鏡法(selective photoconversion microscopy)を用いて、前側膜領域の進行波の前方にレーザー光を照射してそこに存在する膜タンパク質を蛍光標識したところ、周囲の膜環境が前側に変化した後もこれらの膜タンパク質は細胞膜から解離しないことが分かりました。これは、従来考えられていたような細胞膜から解離して後ろ側へ局在化する仕組みでは説明できないことを示唆しています(図1)。
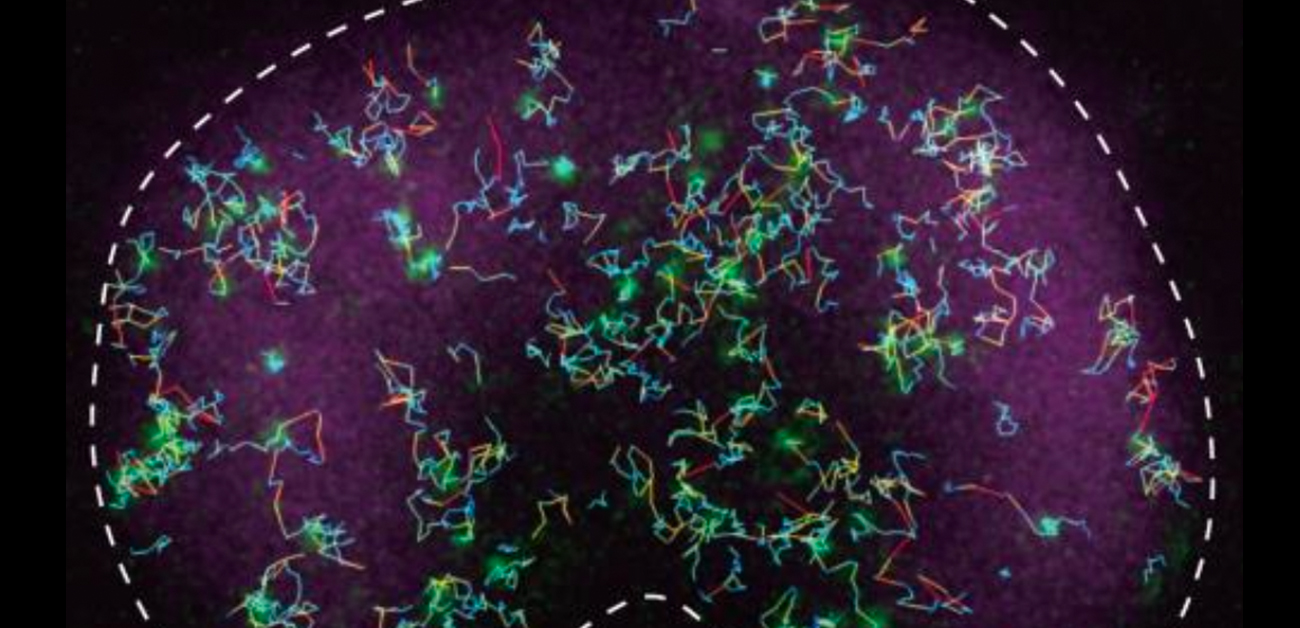
これらの膜タンパク質は細胞膜上を拡散しながら後ろ側へ局在化すると考え、生細胞内1分子イメージング法によりPKBR1の拡散挙動を解析しました。この際、PKBR1を赤色蛍光色素で標識しておき、前側膜領域を緑色蛍光色素で標識して、2色の蛍光を同時に可視化することで、膜領域による拡散の違いを調べました(図2)。この結果、後ろ側膜領域では前側膜領域に比べて拡散が遅くなっていることを発見しました。また、従来モデルの代表的分子であるPTENでは細胞膜結合時間が前側・後ろ側でそれぞれ平均16秒・50秒と大きく異なっていたのに対し、PKBR1は膜領域によらず平均して43秒以上細胞膜に結合していました。これらの結果から、PKBR1は拡散運動の速さの違いによって細胞膜から解離せずに後ろ側へ集積すると考えられ、この新規の局在化メカニズムを「dynamic partitioning」と命名しました。
さらに、このモデルについて検証するために数値シミュレーションを行なったところ、dynamic partitioningのメカニズムによってPKBR1の進行波を形成できることを確認できました。パラメータ等を変更すればPTENのような細胞膜解離に依存した進行波も再現でき、膜タンパク質の自己組織化的な極性形成機構をより普遍的に説明することが可能になりました。最後に、光遺伝学的手法(optogenetics)を用いて、光刺激によって脂質修飾に必要なペプチドを結合することにより、通常は細胞膜に均一に存在する貫通型膜タンパク質を後ろ側に局在化させられることを明らかにしました。この結果は、脂質修飾部分と細胞膜脂質との相互作用がdynamic partitioningを引き起こすのに十分効果的であることを示唆しています。
図2. PKBR1の1分子イメージング. カバーガラスに接している細胞膜近傍を全反射照明蛍光顕微鏡により観察した(白破線). 緑の輝点が1分子のPKBR1、マゼンタの領域が前側膜領域を示す. PKBR1の側方拡散の軌跡を移動距離ごとに色を変えて表示(赤いほど拡散が速い).
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、膜タンパク質が細胞膜上で自己組織化的に非対称局在を形成する仕組みを明らかにすることができました。このような「自発的な対称性の破れ」を通して細胞極性・運動など多様な生命機能を実現する原理の解明に貢献が期待されます。
特記事項
本研究成果は、2023年11月30日(木)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:“A dynamic partitioning mechanism polarizes membrane protein distribution”
著者名:Tatsat Banerjee, Satomi Matsuoka, Debojyoti Biswas, Yuchuan Miao, Dhiman Sankar Pal,Yoichiro Kamimura, Masahiro Ueda, Peter N. Devreotes, and Pablo A. Iglesias
DOI:https://doi.org/10.1038/s41467-023-43615-2
なお、本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「細胞内現象の時空間ダイナミクス」における研究課題「細胞におけるゆらぎの階層性と情報統合ダイナミクス」(研究代表者:上田昌宏)「JPMJCR21E1」、JST戦略的創造研究推進事業(さきがけ)「計測技術と高度情報処理の融合によるインテリジェント計測・解析手法の開発と応用」における研究課題「データ同化による1細胞内自己組織化過程の全可視化」(研究代表者:松岡里実)「JPMJPR1879」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)研究開発領域「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」における研究課題「1分子・質量イメージング顕微鏡の開発と細胞膜機能解析」(研究代表者:上田昌宏)「JP20gm0910001」、日本学術振興会基盤研究A「走化性シグナル伝達系における濃度勾配認識メカニズムの解明」(研究代表者:上田昌宏)「19H00982」、文部科学省新学術領域研究「情報物理学でひもとく生命の秩序と設計原理」における研究課題「細胞内情報伝達の情報熱力学的な理解」(研究分担者:松岡里実)「19H05798」の一環として行われました。
参考URL
用語説明
- 自己組織化
全体として秩序のある構造が物質や分子などの要素から自律的に構築されること。
- 脂質修飾
タンパク質の翻訳後修飾の一種。特定のアミノ酸配列があると、脂質を共有結合する反応が起こる。こうしたアミノ酸配列には複数種類あり、それぞれ異なる長さの炭素鎖が結合する。PKBR1はN末端領域がミリストイル化を、ヘテロ3量体Gタンパク質βγサブユニットはγサブユニットがプレニル化を、低分子量Gタンパク質RasGはC末端領域がプレニル化を受ける。
- 興奮系
進行波などの時間的・空間的に特徴のあるパターンを生成する系。内因的なノイズを利用してパターンを生成するため、自己組織化の重要なしくみの一つとなっている。同じしくみは神経細胞で活動電位が発生する際にも用いられている。
- 進行波
空間パターンが一定の方向に伝搬するダイナミクス。本研究では細胞膜上をPI(3,4,5)P3に富んだ前側膜領域が伝搬する現象を対象にしており、進行波の前方ではPI(4,5)P2からPI(3,4,5)P3へのリン酸化、後方ではPI(3,4,5)P3からPI(4,5)P2への脱リン酸化が起こることで膜領域が空間的に伝搬するように観察される。
