大規模細胞内1分子イメージングによる 新規薬剤スクリーニングを実現
新規治療薬探索やドラッグリポジショニングへの応用に期待
研究成果のポイント
- 細胞内の生体分子のふるまいを観測する1分子イメージングを応用して、生体分子のはたらきを阻害する化合物をスクリーニングする手法の開発に成功
- 生体分子の拡散運動や多量体形成といった、従来は薬剤探索に使われていない分子のふるまいを見て薬剤の作用を評価し、細胞の生存に効果を示す薬剤スクリーニングが可能に
- 既存薬とは異なる作用機序を持つ薬剤の開発や、承認済みの薬剤のリポジショニングへの応用に期待
概要
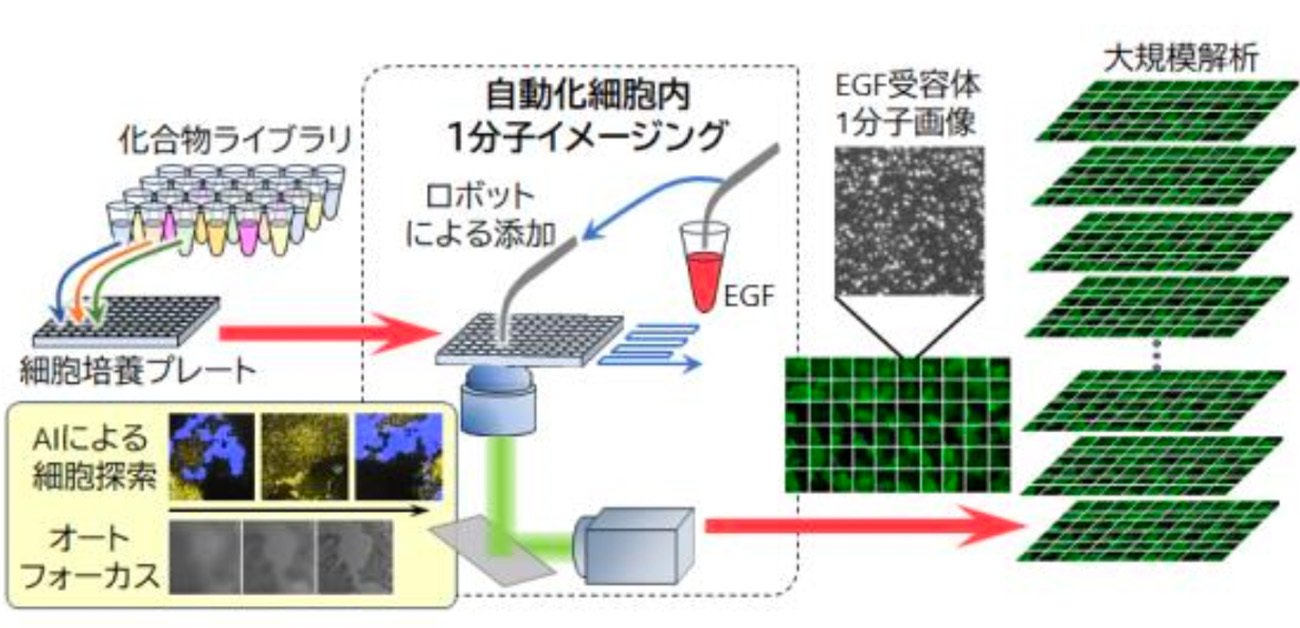
大阪大学大学院生命機能研究科の大学院生の渡邉大介さん、廣島通夫特任准教授(常勤、理化学研究所生命機能科学研究センター客員研究員)、上田昌宏教授(理化学研究所生命機能科学研究センターチームリーダー)らの研究グループは、細胞内蛍光1分子イメージング法を用いた新しい薬剤スクリーニング手法を確立しました。
細胞内1分子イメージングは、生体分子の活性化/不活性化に伴う運動の変化や多量体の形成を観察できることから、薬剤スクリーニングへの応用が期待されてきました。しかし、細胞内1分子イメージングは経験や時間を要する工程が多いため計測の効率が悪く、薬剤スクリーニングに必要とされる大規模な計測には不向きでした。
研究グループは、機械学習やロボティクスなどの自動化技術を導入することで、大規模細胞内1分子イメージングシステム(AiSIS)を理化学研究所と共同で2018年に完成させています*。今回、この計測システムのスループットをさらに向上し、研究者による手動計測の100倍を超える計測速度を達成したことから、薬剤スクリーニングへ応用しました。
開発した手法を用いて様々ながんの発生に関与する上皮成長因子(EGF)受容体のふるまいを観察し、1000種類を超える承認薬を含んだライブラリに対して薬剤スクリーニングを行ったところ、EGF受容体のはたらきを阻害することが既に知られている薬剤の全てをライブラリの中から正確に見つけることができました。さらに、EGF受容体への作用が知られていない薬剤も承認薬ライブラリに含まれていることを発見しました。
この手法により、薬効がありながらも従来は除外されてきた化合物が見つかる可能性があることから、新規の治療薬候補の探索や既に承認されている薬剤のリポジショニングへの応用などが期待されます。
本研究成果は、米国科学誌「Nature Communications」に、10月18日(金)5時(日本時間)に公開されました。
*細胞内1分子自動観察システム「AiSIS」
-顕微鏡操作、細胞認識、1分子観察を人工知能で完全に自動化-
https://www.riken.jp/press/2018/20180926_1/index.html
図1.(上)細胞内1分子イメージングを用いた薬剤スクリーニングの概要。(下)受容体の拡散運動の速さ(左)や多量体の形成(右)を1,000細胞の規模で計測できる。細胞毎に受容体の拡散運動の速さと多量体の量を計測し、得られる頻度分布をヒートマップで示した。これらの頻度分布はEGF刺激の有無によって変化する。
研究の背景
細胞を取り巻く環境の変化に適切に応答するため、細胞内では分子間で情報をやりとりするシグナル伝達が行われています。細胞膜にある受容体はこの伝達経路の最上流に位置し、外部からの刺激などを細胞内に伝える役割を担っている分子です。そのひとつ、上皮成長因子(EGF)受容体は、細胞の増殖や分化、アポトーシスといった、生体の恒常性を保つために大切なシグナル伝達に関与しています。がんは細胞増殖に異常が生じる病気ですが、多くのがん細胞でEGF受容体の過剰な発現や突然変異などの異常が見られることから、抗がん剤を開発する際の主要な標的分子となっています。これまで、EGF受容体関連のがん、特に非小細胞肺がんに対して数多くの薬が開発されてきました。これらの多くは、EGF受容体のチロシン残基のリン酸化を阻害することでEGF受容体の異常な活性化を抑える薬として知られ、チロシンキナーゼ阻害薬(Tyrosine Kinase Inhibitors, TKIs)と呼ばれています。
EGF受容体はリガンドであるEGFと結合すると、安定な二量体が形成されることで自己リン酸化が引き起こされて活性化します。近年、研究グループは細胞内で個々の分子を観察できる細胞内1分子イメージングを用いて、EGF受容体がリン酸化されると細胞膜上での動き(側方拡散運動)の速さが低下するとともに、多量体が形成されることを明らかにしています。また、EGF刺激によるこうした受容体の変化はTKIsによって抑えられることも分かってきました。特に、EGF受容体の動きの定量解析から得られたEGFやTKIsの効果を表す数値(EC50やIC50)が、従来手法で得られた値とよく一致することが示されています。これらの結果から、細胞内1分子イメージングを用いた薬剤スクリーニングの可能性が期待されてきました。
しかしながら、1分子イメージングは熟練した研究者の手技に依存する工程を多く含むため、薬剤スクリーニングに必須である大規模計測には不向きでした。そこで研究グループは、1分子イメージングのほぼ全てを自動化した計測システム「AiSIS(Automated in-cell Single-molecule Imaging System)」を2018年に開発しています。この計測システムでは、高倍率下での焦点合わせやAIを用いた観測に適した細胞の探索、ロボットアームを用いた薬剤添加の操作などを組み合わせることで、手動による計測よりも100倍を超える速い計測スループットが達成されました。従来の手動計測では現実的な時間内で実行することが極めて難しかった大規模計測が実現したことから、今回、薬剤スクリーニングへ応用しました。
研究の内容
研究グループはAiSISを用いて、EGF受容体のTKIsを含むアメリカ食品医薬品局(FDA)の承認薬ライブラリを対象に、EGF受容体の1分子イメージングに基づいた薬剤スクリーニングを行いました。薬剤で細胞を処理し、各種類それぞれEGFの添加前後で20細胞ずつ1分子イメージングを実施しました。一連の計測により、4.5万個の細胞から約1億分子についてデータを取得し、EGF受容体の運動と多量体形成を反映する蛍光強度の変化を解析しました。その結果、承認薬ライブラリが含む1,134種類の薬剤の中から、EGF受容体の分子動態を変化させる薬剤が17種類、検出されました。そのうち、EGF受容体の活性化によって起こる動きの変化を抑制する薬剤が10種類あり、これらはライブラリに含まれるEGF受容体のTKIsに漏れなく相当していました。この結果は1分子イメージングによってTKIsのスクリーニングが可能であることを実証しています。また、残りの7種類は、EGF受容体に対する効果が知られていない薬剤ですが、いずれもEGF受容体の拡散運動や多量体形成を阻害する効果が見られました。これらの化合物はEGF受容体のTKIsではありませんが、EGF受容体の内在化を促進して、細胞膜上のEGF受容体の発現量を低下させることで、細胞の生存率を低下させる効果を示すことが分かりました。EGF受容体のリン酸化の阻害とは異なるメカニズムによって、EGF受容体の機能を阻害する薬剤が取得できたことになります。
図2. スクリーニングに用いたライブラリ(上)。カラーで示すドットは選択された化合物で、TKIs(下左10種)とそれ以外の化合物(下右7種)が含まれる。MSD(平均二乗変位)は分子の運動領域の指標。
図3. 本研究のスクリーニングから得られた、EGFRに対して異なる効果を示す化合物。
本研究成果が社会に与える影響(本研究成果の意義)
大規模細胞内1分子イメージングを薬剤スクリーニングに応用することで、受容体のシグナル伝達に伴って起こる拡散運動の変化や多量体形成、内在化などの複数のイベントに作用する薬剤が得られました。そのため、本スクリーニング手法は、新たな作用機序を持つ薬の発見に寄与できる可能性があります。現行のスクリーニング指標では見逃してしまう化合物も選択できることから、新規の薬剤探索や既に承認されている薬のリポジショニングへの応用なども期待されます。これまで評価が難しかった疾患に対する薬剤を探索する場合に、有効な手法の選択肢の一つとなると考えられます。また、本手法の基盤となっている自動化された大規模細胞内1分子イメージングは、細胞膜に存在する受容体やイオンチャネルなどの膜蛋白質の機能発現の仕組みを明らかにする基礎研究に対しても有効な手法を提供しています。
特記事項
本研究成果は、2024年10月18日(金)5時(日本時間)に米国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:“Single molecule tracking based drug screening”
著者名:Watanabe D, Hiroshima M, Yasui M, and Ueda M.
DOI:https://doi.org/10.1038/s41467-024-53432-w
なお、本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST(上田:JPMJCR21E1)、日本医療研究開発機構(AMED) 橋渡し研究プログラム(上田:JP23ym0126815)、日本学術振興会(JSPS) 科学研究費補助金 基盤研究B(廣島:18H01839, 22H02593)、新学術領域研究(廣島:18H05414)、大阪大学創薬サイエンス研究支援拠点AMED BINDS(上田: JP24ama121054)、理化学研究所 創薬・医療技術基盤プログラム(DMP)による支援を受けて行われました。
参考URL
SDGsの目標
用語説明
- 薬剤スクリーニング
新薬開発の初期段階で、多数の化合物から有望な候補を選別するプロセス。疾患に関与する標的分子や細胞現象が特定されている場合、それぞれ標的ベーススクリーニングや表現型スクリーニングといった手法が用いられる。近年では、ロボティクスの導入などで各工程を自動化し、数万から数百万の化合物を迅速に評価することができるハイスループットスクリーニング(HTS)が主流となっている。得られた候補化合物は、さらなる研究や試験により薬としての可能性を評価される。
- 細胞内蛍光1分子イメージング
観測対象の蛋白質分子を蛍光色素・蛋白質によってラベルし、顕微鏡で個々の分子を観察する手法。照明光をガラス基板と細胞の界面で全反射させると、エバネッセント光と呼ばれる特殊な光が発生し、ガラス表面のごく薄い領域(約150 nm) のみ照明することができる。これにより、従来の蛍光顕微鏡に比べて背景光が大幅に軽減され、さらに高感度カメラを用いることで、蛍光ラベルされた1分子の像を高いコントラストで得ることができる。細胞での1分子イメージングは2000年に大阪大学で最初に成功しており、細胞膜上における分子の動きや分子間の相互作用(リガンド結合や複合体形成)を1分子レベルで可視化できるようになった。
- 上皮成長因子(EGF)
細胞膜上に局在するチロシンキナーゼを有する受容体で、EGFと結合すると二量体を構成する分子間でリン酸化が生じ、下流のシグナル伝達経路を活性化する。その結果、細胞の増殖や分化、運動など多くの応答が引き起こされる。多くのがん細胞でEGF受容体の過剰発現や遺伝子変異が見られるため、抗がん剤の主な標的分子のひとつである。




