ほ乳類のオス化を促す新たなメカニズムを発見
オス化経路が正しく進むためには、メス化経路を抑えておくことが重要
研究成果のポイント
- ほ乳類の性決定にエピゲノム制御因子CDYLが重要な役割を果たすことを解明
- ほ乳類の性決定に関わるジェネティックな遺伝子発現制御メカニズムの全容は不明だったが、今回その一端を解明
- 本研究成果はヒト性分化疾患の原因及びメカニズム解明に繋がる可能性
概要
大阪大学大学院生命機能研究科の岡下修己助教と立花誠教授の研究グループは、ほ乳類の性決定にエピゲノム制御因子であるCDYLが重要な役割を果たすことを世界で初めて明らかにしました。
ほ乳類における雄の性分化には精巣誘導因子であるSryやSox9が、胚発生期の生殖腺で発現することが必須です。近年それに加えて卵巣への分化誘導を抑制することも重要であることが分かってきました。しかし、卵巣への分化誘導がどのような因子によってどのように抑制されているのかは不明な点が多く残されていました。
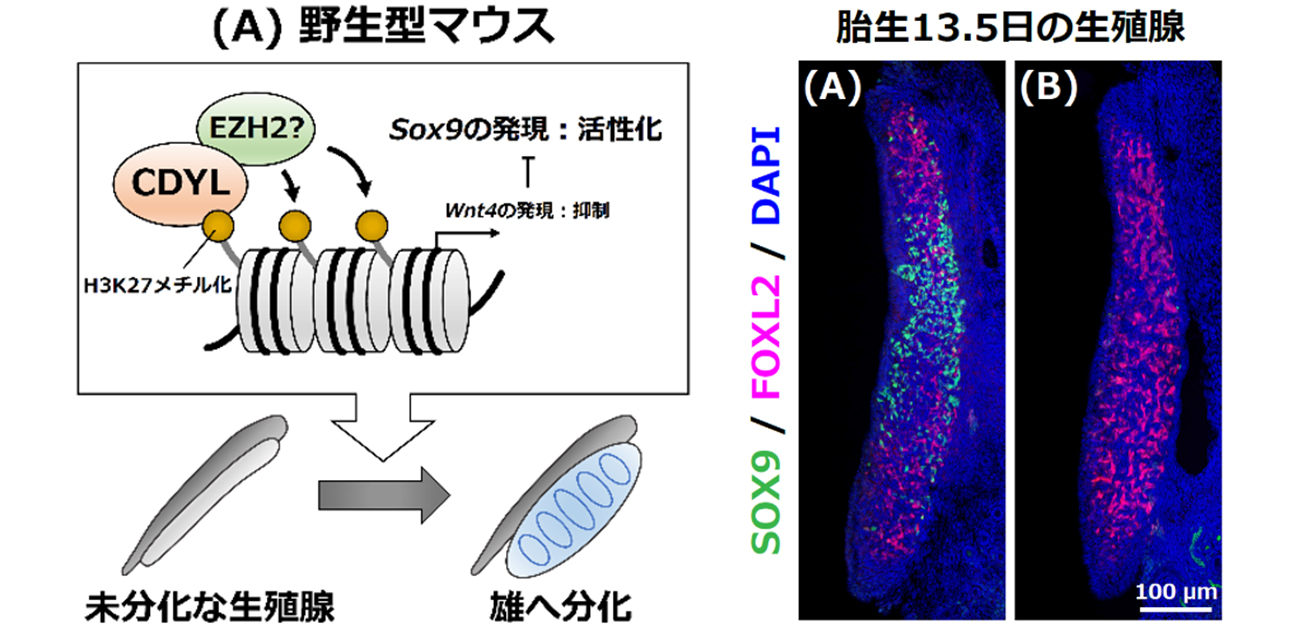
今回、立花誠教授らの研究グループは、Cdyl欠損マウスの一部において、性染色体がXYであるにも関わらず雌化する個体が出現することを発見しました。そこで、CDYLがどのようなメカニズムで雄の性分化に関わっているのかを解析しました。その結果、CDYLは、転写の抑制に寄与するエピゲノム修飾のヒストンH3にある27番目のリジンでトリメチル化(H3K27me3)を維持することで、卵巣分化に関わるWnt4の発現を負に制御していました。このWNT4は抗精巣因子としてSox9の発現抑制に働くことが知られています。つまり、Cdyl欠損マウスでは、H3K27me3の維持ができなくなり、Wnt4の発現抑制が起きなくなることで、WNT4がSox9の発現を抑制してしまい、雄から雌への性転換が引き起こされていました(図1)。
ヒトの性分化疾患(Disorders of Sex Development : DSD)は性の決定・分化が正しく進行しない場合に発症する病気で、その半数以上の症例で原因は未だ不明となっています。本研究成果は、ほ乳類の性決定の仕組みの一端を明らかにしたことで、性分化疾患発症の新たな原因及びメカニズムの解明に繋がることが期待されます。
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」に、5月9日(火)に公開されました。
図1
(A)野生型のマウスではCDYLが
研究の背景
真核生物の遺伝情報は、ゲノムDNAとヒストンで構成されるクロマチンに保存されています。クロマチンの構造変化は、転写の活性化や抑制に密接に関係しており、クロマチン中のDNAやヒストンの共有結合による化学修飾はクロマチンの構造変化による転写調節に不可欠な役割を果たしています。DNAやヒストンには様々な化学的修飾が付加され、クロマチンに異なる転写能力を付与しています。これらのプロセスに寄与する多くの酵素は、DNA/ヒストンに化学修飾を導入する「ライター(writer)」とそれを除去する「イレーザー(eraser)」に分類されます。ライターとイレーザーに加えて、クロマチン環境下での遺伝子制御に重要な役割を果たすのが「リーダー(reader)」タンパク質です。リーダーは対応する修飾を認識し、クロマチンの構造を変化させることで転写の活性化や抑制など特定の生物学的出力に変換します。
性決定とは、性的に未分化な胚生殖腺を精巣か卵巣のいずれかに分化させるよう方向づける発生上の決定を指します。ほ乳類では、未分化な性腺体細胞においてY染色体連鎖遺伝子Sryが発現することにより、セルトリ細胞への分化が促進され、精巣促進経路が活性化されます。マウスのSryは、ほ乳類の性決定に関するモデルとして最も精力的に研究されています。マウスSryの発現は空間的、時間的に厳密に制御されており、胚性生殖腺体細胞の限られた集団で、胎生10.5日から12.5日までの限られた期間でのみ発現することが知られています。近年、遺伝学的研究によって、DNA/ヒストンの化学修飾が性決定に大きく寄与していることが明らかになってきました。
立花誠教授らの研究グループは以前、H3K9脱メチル化酵素JMJD1Aが、雄性生殖腺の性決定時に抑制に寄与するエピゲノム修飾であるH3K9me2を除去してSryの転写を活性化することを示しました。Jmjd1aを欠損したマウスでは、Sry遺伝子座のH3K9me2の増加に伴うSryの発現低下により、雌への性転換が生じることが明らかになりました。さらに、H3K9メチル化酵素GLP/G9aがJMJD1Aを介したSryの活性化に対抗して機能することも明らかにしました。ヘテロ接合性のGLP変異は、Sry遺伝子座のH3K9me2を減少させSryの発現を増加させることにより、Jmjd1a欠損マウスの性転換をレスキューしました。これらの研究から、GLP/G9a複合体とJMJD1Aが、それぞれSry遺伝子座のH3K9me2を調整するライターとイレーザータンパク質であることが示されました。一方でSry遺伝子座のH3K9me2を認識するリーダータンパク質に関しては不明でした。
研究の内容
立花誠教授らの研究グループは当初、Sry遺伝子座のH3K9me2を認識するリーダータンパク質の同定を目的として研究を進めていました。CDYLはその候補因子の一つとして注目していました。CDYLはヒストンの化学修飾を認識するクロモドメインを有しており、GLP/G9a複合体だけでなくH3K27メチル化酵素EZH2とも相互作用し、転写の抑制に働くリーダータンパク質として知られています。もし、CDYLがSry遺伝子座のH3K9me2を認識するリーダータンパク質であるならば、ヘテロ接合性のCdyl変異は、Sry遺伝子座のH3K9me2を減少させ、Sryの発現を増加させることにより、Jmjd1a欠損マウスの性転換をレスキューすることが予想されました。しかし、その予想に反して、Cdylの変異はJmjd1a欠損マウスの表現型をより悪化させてしまいました(図2)。この結果は、CDYLが精巣促進経路に対して正の制御因子であることを示していました。
上記の結果を受け、Cdyl欠損マウスが性転換を引き起こすのか解析を行いました。雌雄のCdylヘテロ欠損マウスを用いてCdyl欠損マウスを作製したところ、産まれてきたY染色体を有する(XY型)Cdyl欠損マウスの一部に卵巣を2つ有する性転換個体が出現することが明らかになりました(図3)。以上の結果から、CDYLが精巣促進経路に対して正の制御因子であることが確認されました。
続いて、CDYLがどのようなメカニズムで精巣の分化に貢献しているのか解析を進めました。まず、Cdylの欠損によってどのような遺伝子の発現に影響があるのか、性決定期の胚性生殖腺体細胞からRNAを回収し、網羅的遺伝子発現解析(RNA-seq)を行いました。その結果、Cdyl欠損マウスの胚性生殖腺では、セルトリ細胞の分化に重要なSox9の発現が顕著に低下していることが明らかになりました。しかし、CDYLは転写に抑制的に働くので、このSox9の発現低下は間接的な影響であることが考えられました。そこで、Sox9の発現に対 して負に働く抗精巣遺伝子に着目して、その発現を調べたところ、Cdyl欠損マウスの胚性生殖腺体細胞においてWnt4の発現が上昇していることが分かりました。Cdyl欠損マウスの胚性生殖腺におけるWnt4の発現上昇とSox9の発現減少の因果関係を評価するために、Wnt4の遺伝子量を減らすことでCdyl欠損マウスの胚性生殖腺におけるSOX9発現が回復するのかどうかを検討しました。Wnt4ヘテロ欠損体を作製し、Cdylヘテロ欠損体と順次交配していき、XY型Wnt4ヘテロ欠損;Cdyl欠損マウスが得られたところで、その個体の胚性生殖腺を調べました。その結果、XY型Wnt4ヘテロ欠損;Cdyl欠損マウスの胚性生殖腺では同腹のXY型Cdyl欠損マウスに比べ、SOX9の発現が回復しており、Cdyl欠損マウスの表現型がレスキューされていました。これらの結果は、Cdyl欠損
マウスの胚性生殖腺におけるSox9の発現低下が、Wnt4の発現上昇の結果である可能性を支持していました。
最後に、雄性生殖腺の性決定時に、CDYLがWnt4遺伝子座を直接標的とするかどうかを検討しました。CDYLの標的遺伝子座を決定するために、性決定期の生殖腺体細胞を精製し、クロマチン免疫沈降法(ChIP) を行いました。その結果、CDYLはWnt4のプロモーター領域に特異的に結合することが明らかになりました。さらに、Cdyl欠損がWnt4プロモーター領域のエピジェネティックな状態にどのような影響を及ぼすのか評価しました。ChIP解析の結果、性決定期のCdyl欠損マウスの生殖腺体細胞では、Wnt4プロモーターにおいてH3K27me3が減少していました。以上の結果より、CDYLはWnt4のプロモーター領域に直接結合し、その領域のH3K27me3レベルを維持することによってWnt4の発現を抑制することが示されました。
ほ乳類の性発生に関する最新の知見により、未分化生殖腺の性的な運命決定は、Sryの転写活性化だけでなく、精巣促進遺伝子と卵巣促進遺伝子の間の微妙な発現バランスに依存していることが示唆されています。立花誠教授らの研究グループは今回、エピジェネティックリーダータンパク質CDYLが卵巣促進遺伝子Wnt4の発現を抑制し、精巣促進遺伝子と卵巣促進遺伝子の間の発現バランスを傾けることによって、雄性生殖腺の性決定を強化することを明らかにしました。
図2
(A)XY型
図3
(A)XY型
本研究成果が社会に与える影響(本研究成果の意義)
ヒトDSDの症例の半数以上において、性決定や性腺の発達に必要な遺伝子の変異だけでは説明がつかないことが知られています。近年、ヒトのエクソームシーケンス解析により、46XY性腺形成不全を伴うDSD患者において、ヒストンアセチル化酵素であるCBP/p300の変異が発見されました。この結果から、DSDの発症には、胚発生時の遺伝的な変異だけでなくエピジェネティックな変異の両方が関与している可能性が示唆されています。また、マウスCBP/p300はSryの活性化に重要であり、それらの変異は雄から雌への性転換を引き起こすことから、男性性発達におけるエピゲノム制御因子の役割がマウスとヒトで保存されている可能性があることも考えられています。本研究成果により、エピジェネティックな制御を介したほ乳類の性決定の仕組みの一端が明らかにされたことで、性分化疾患発症の新たな原因及びメカニズムの解明に繋がることが期待されます。
特記事項
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」に、5月9日(火)に公開されました。
タイトル:“CDYL reinforces male gonadal sex determination through epigenetically repressing Wnt4 transcription in mice”
著者名:Naoki Okashita, Ryo Maeda, Makoto Tachibana
なお、本研究は、日本学術振興会科学研究費補助金、日本学術振興会科学研究費助成事業新学術領域研究「性スペクトラム:領域代表 立花誠」の一環として行われました。
参考URL
立花研究室ホームページ
http://tachibana-lab.net
SDGsの目標
用語説明
- セルトリ細胞
精上皮の基底側から管腔側に向かって伸びる柱状の大型の細胞で、生殖細胞を物理的に支えるだけでなく、様々なサイトカインを分泌して生殖細胞に与えることで、生殖細胞の維持・分化に寄与している。
- 網羅的遺伝子発現解析(RNA-seq)
次世代シーケンサーを利用した遺伝子発現量の定量方法の一つである。全転写産物の塩基配列を決定することにより、転写産物量を網羅的に推定できるだけでなく、新規転写産物の探索も可能である。
- クロマチン免疫沈降法(ChIP)
生細胞内でのクロマチンや転写因子などの特定のタンパク質についてゲノム上の相互作用部位を決定するために使用される方法である。ホルムアルデヒドでタンパク質とDNAの結合をクロスリンクした後に目的のタンパク質に特異的な抗体を用いて免疫沈降を行い、共沈したDNAをPCRやDNAシーケエンスにより解析することで、タンパク質のDNA結合部位(配列)を明らかにすることができる。
- プロモーター領域
DNAにおける遺伝子の転写制御を行う領域である。転写調節因子群の働きにより、転写基本因子群とRNAポリメラーゼがプロモーター上に転写開始複合体を形成し、転写が開始される。
- エクソームシーケンス解析
ゲノムからエクソン領域を濃縮し、次世代シーケンサーにより塩基配列を決定する方法で、低コストで大量にデータを取得することができる。


