血管透過性を抑制する戦略で病原体を選ばない重症感染症治療薬の開発へ
新型コロナウイルス感染症・敗血症の死亡率の低減に期待
研究成果のポイント
概要
大阪大学大学院薬学研究科の大学院生の森田真綾さん(博士後期課程)、岡田欣晃准教授らの研究グループは、血管透過性を抑制する機能を持つRobo4遺伝子の発現量を増やすことで、重症感染症(敗血症)マウスの血管透過性の亢進と、死亡率を軽減できることを発見しました。またRobo4遺伝子の発現を調節する仕組みの解明から、Robo4量を増やす薬(ALK1阻害剤)を同定し、この薬で肺の血管透過性を下げ、敗血症・新型コロナウイルス感染症マウスの死亡率を低減できることを証明しました。
これまでに、病原体、免疫細胞、炎症性サイトカインを標的とする優れた重症感染症の治療薬が開発されてきましたが、これらを用いてもなお死亡率の低減が難しいことが問題となっていました。今回、岡田准教授らの研究グループは、既存薬が標的としてこなかった、重症感染症における「血管透過性の亢進」のプロセスに着目し、これを抑制する戦略で重症感染症の治療ができる可能性を見出しました。本研究で提案する血管を標的とする治療薬は、理論上、病原体を選ばない作用機序のため、今後出現する新しい重症感染症の予防・治療薬の開発と、死亡率低減に貢献することが期待されます。
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences」に、1月13日(金)に公開されました。
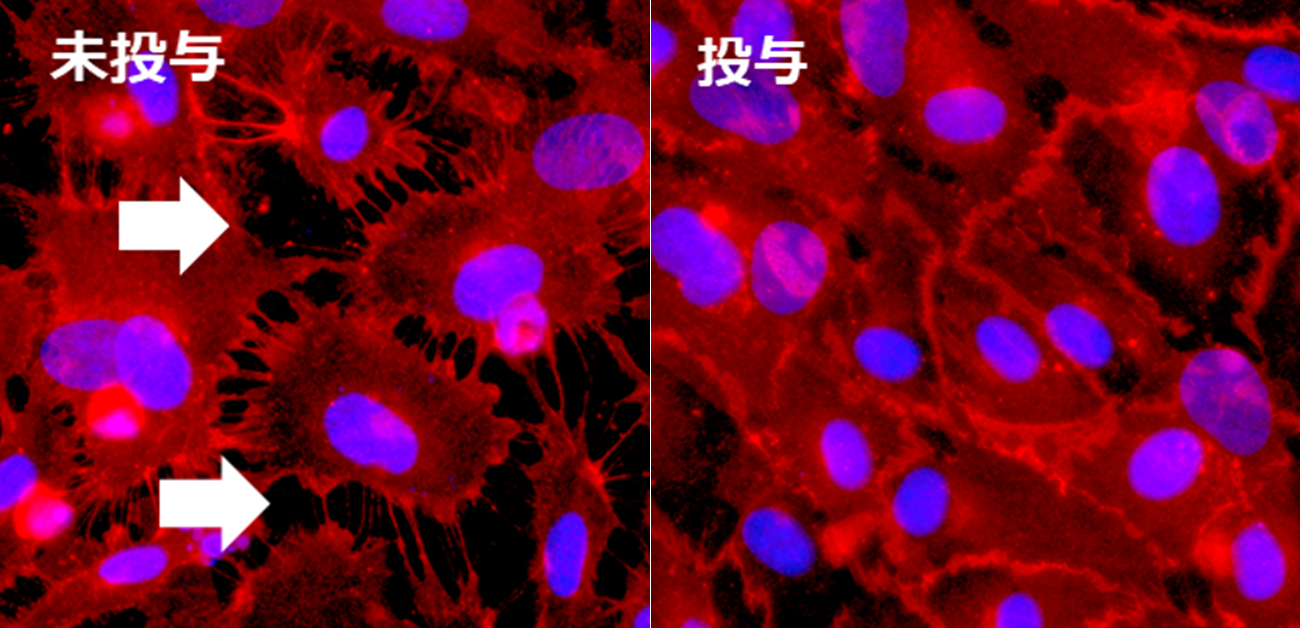
血管透過性抑制薬と新型コロナウイルス感染症の治療効果
研究の背景
近年、新型コロナウイルス感染症をはじめとする新興・再興感染症により、世界で多数の人命が失われています。これまでに、感染症の病態を増悪させる、病原体の増殖、免疫細胞の活性化、炎症性サイトカインを抑制する、優れた治療薬が開発されてきました。しかし、これらを活用してなお死亡率を充分に低減できないことが問題となっており、新しい治療薬の開発が急務となっています。
岡田准教授らは、重症感染症の病態誘導のプロセスのうち、これまで治療薬が開発されてこなかった、「血管透過性の亢進」のプロセスに着目し、これを抑制する治療薬の開発を目指してきました。今回の研究では、血管内皮細胞どうしの接着を強め透過性を抑制するタンパク質Roundabout4(Robo4)に着目し、その量を増やす戦略で重症感染症の病態を治療できるかを解析しました。
研究の内容
岡田准教授らは、血管内皮細胞におけるRobo4量を増やしたマウスを作製し、細菌の膜成分であるリポポリサッカライド(LPS)を投与して敗血症を誘導しました。その結果、Robo4を増やしたマウスでは、肺の血管透過性が抑制され、死亡率が低下しました。このことからRobo4量を増やす戦略が重症感染症の有効な治療戦略となることがわかりました。そこでRobo4量を増やす薬を開発するために、まずRobo4量が調節される仕組みを解析し、SMADとよばれるタンパク質を介する2つの仕組みで、Robo4量が正と負に調節されていることを突き止めました。この発見をもとに、Robo4量を増やす薬として、ALK1阻害剤を同定し、この薬でマウス肺の血管透過性を下げ、敗血症の死亡率を低下できることを証明しました。最後に、この薬が新型コロナウイルスによる血管内皮細胞の接着の破綻を抑制し、同ウイルス感染マウスの肺障害と死亡率を抑制することを示しました。これらの研究から、Robo4を増やし血管透過性を下げる薬で、重症感染症の病態や死亡率を低減できることが示されました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、既存薬と異なる機序で作用する「血管透過性を抑制する薬 (Robo4を増やす薬)」で、重症感染症の病態や死亡率を低減できることがわかりました。この「血管透過性抑制薬」は、理論上、病原体の種類を選ばず、既存薬との併用も可能なため、今後脅威となる新しい感染症の予防・治療薬となりうると期待されます。
特記事項
本研究成果は、1月13日(金)に米国科学誌「Proceedings of the National Academy of Sciences」(オンライン)に掲載されました。
タイトル:“Upregulation of Robo4 expression by SMAD signaling suppresses vascular permeability and mortality in endotoxemia and COVID-19 models”
著者:Maaya Morita†, Aki Yoneda, Nagisa Tokunoh, Tatsumi Masaki, Keisuke Shirakura, Mayumi Kinoshita, Rina Hashimoto, Naoya Shigesada, Junya Takahashi, Masashi Tachibana, Shota Tanaka, Masanori Obana, Nobumasa Hino, Masahito Ikawa, Kazutake Tsujikawa, Chikako Ono, Yoshiharu Matsuura, Hiroyasu Kidoya, Nobuyuki Takakura, Yoshiaki Kubota, Takefumi Doi, Kazuo Takayama, Yasuo Yoshioka, Yasushi Fujio, Yoshiaki Okada* (†筆頭著者, *責任著者)
DOI number: 10.1073/pnas.2213317120
なお本研究は、国立研究開発法人日本医療研究開発機構(AMED)(「新興・再興感染症に対する革新的医薬品等開発推進研究事業」ほか)、日本学術振興会 科研費、武田科学振興財団、臨床薬理研究振興財団、持田記念医学薬学振興財団、日本財団・大阪大学感染症対策プロジェクトの支援を受けて行われました。
参考URL
岡田欣晃准教授 Researchmap
https://researchmap.jp/magic_roundabout
SDGsの目標
用語説明
- 血管透過性の亢進
病原体の感染時に、血管は透過性を高め、免疫細胞を動員することで病原体を効率的に排除する。重症感染症においては透過性が過剰に亢進することで、病態が誘導される。
- 血管内皮細胞
血管の内側を覆う細胞。この細胞どうしが接着することにより血管内皮のバリア機能が生み出され、物質や免疫細胞の通過が制御される。
- Roundabout4(Robo4)
血管内皮細胞に特異的に発現する。細胞間の接着を強め、疾患時の血管透過性を下げる機能を持つ。
- 敗血症
敗血症は、感染症をきっかけとする全身性の炎症反応症候群。炎症や血管透過性の亢進を誘導する炎症性サイトカインの血中濃度が過剰に高まり、多臓器不全やショックを引き起こす。
- ALK1阻害剤
Robo4の発現を抑制するSMAD1/5にシグナルを伝えるタンパク質の機能を抑制する化合物。
- 血管内皮細胞の接着の破綻
新型コロナウイルスが血管内皮細胞の接着を壊し、隙間を生じさせる現象。この現象でウイルスは血管内に侵入する (岡田准教授らが発見し、昨年9月にSci Adv誌に報告)。
