肝細胞内の薬物代謝活性を光で可視化することに成功
分子レベルの薬物応答をイメージングする
研究成果のポイント
- 薬物代謝酵素の活性と相関するラマン分光シグナルを同定
- 細胞を破壊せず光を当てるだけで細胞内の薬物代謝酵素(CYP)活性の可視化に成功
- 医薬品開発における副作用評価や再生医療などで用いる細胞製品の品質管理に貢献
肝細胞(肝実質細胞)内の薬物代謝酵素(CYP)活性の可視化に成功
CYPの発現を誘導する薬剤(リファンピシン)の添加量(0~4 µM)が増加すると肝細胞内のCYP活性が上昇。
(※赤色:シトクロムc、緑色:CYP活性)
概要
国立研究開発法人 産業技術総合研究所(以下「産総研」という)先端フォトニクス・バイオセンシングオープンイノベーションラボラトリ 李 梦露 特別研究員(現:大阪大学大学院工学研究科 特任助教(常勤))、名和 靖矩 特別研究員(現:関西学院大学 専任講師)、藤田 聡史 副ラボ長らと、大阪大学大学院工学研究科 藤田 克昌 教授らの共同研究グループは、肝細胞(肝実質細胞)で発現する薬物代謝酵素(CYP)の酵素活性が、酸化型CYPの分子数と相関しているため、この酵素群の分子をラマン散乱により検出すると、CYPの酵素活性を推定できることを発見しました。この知見に基づき、ラマン散乱顕微鏡を用いて、生きた無標識の細胞を破壊することなく、光を当てるだけで、CYPの酵素活性の細胞内分布を可視化することに成功しました。また、他の生体分子のラマン散乱を同時に検出することにより、薬物に対する細胞応答を多角的に解析できることを示しました。本技術は、創薬開発における肝臓の薬物応答試験や再生医療で用いる肝細胞製品の品質評価への応用が期待されます。
なお、この技術の詳細は、2022年8月22日(英国夏時間)に「Communications Biology」に掲載されました。
開発の社会的背景
薬物代謝酵素(CYP)は、主に肝細胞や小腸上皮細胞で発現し、投与された薬物の代謝に関与しています。薬物によるCYP活性の誘導や阻害は、しばしば予期せぬ薬物有害反応(ADR)を引き起こすため、医薬品開発においては、CYPの活性を含む肝代謝の評価を行うことが必要です。薬物代謝の定量評価は、コンピュータのみでは困難なため、肝細胞や動物モデルを用いた薬物応答試験も併用して行われています。また、再生医療に活用することが期待されている肝細胞などの細胞製品の品質管理においても、肝臓の重要な機能であるCYP活性の評価は必要不可欠です。
現在の CYP 活性の評価は、蛍光法・発光法などを用いたエンドポイント測定や質量分析法などの破壊的かつ1回限りの手法に依存しており、活性の細胞内分布や経時変化の測定は困難で、これが研究開発および製品開発の妨げになっています。
研究の経緯
産総研は、大阪大学と「フォトニクス分析の高度基盤技術を実装し、多彩な生体分子を計測する次世代バイオセンシングシステムに関する研究開発に係る研究拠点の設置・運用に関する覚書」を締結し、2017年1月6日より大阪大学吹田キャンパス内に「産総研・阪大 先端フォトニクス・バイオセンシングオープンイノベーションラボラトリ」を設置し、「ひとつ屋根の下(under one roof)」の体制で共同研究開発を実施しています。2022年1月6日からは第二期計画を開始し、「健康不安なく人生を楽しむヘルスケア社会の実現」を目標として革新的な診断機器、創薬/再生医療ツール、健康モニタリング技術の社会実証/実装研究を進めています。
本研究では、開発目標の一つである「無標識で細胞/組織の分子情報を取得する技術開発と医療機器への応用」において、ラマン分光技術を応用して大阪大学が開発した「ラインスキャンが可能な高速ラマン顕微鏡」を活用しました。本顕微鏡を用いて、低侵襲かつ非破壊的に肝細胞の分子を可視化し、肝細胞の品質や状態を把握する技術の開発を行っています。その取り組みの中で、肝細胞で発現する薬物代謝酵素(CYP)の酵素活性と酸化型CYPの分子数とのあいだに相関があることを発見しました。この発見を利用して、細胞内の酸化型CYP酵素群をラマン散乱により検出し、CYPの酵素活性を測定する技術を開発しました。CYPは肝細胞での薬物や毒物の代謝において重要な役割を担っており、かつCYP活性と他の生体分子をラマン散乱により同時に検出できるため、開発した技術は薬物に対する細胞応答を多角的に解析することを可能とします。
なお、本研究開発は、国立研究開発法人科学技術振興機構の委託事業「研究成果展開事業 共創の場形成支援プログラム(共創分野・育成型/本格型)(2020~2021年度/2022~2031年度)(JPMJPF2009)」および「戦略的創造研究推進事業 CREST(2019~2024年度)(JPMJCR1925)」による支援を受けています。
研究の内容
本研究では、大阪大学が開発した高速ラマン顕微鏡を用いて、肝細胞内の分子が持つラマンスペクトルを解析し、肝細胞の分化度や成熟度の測定とこれに基づく細胞品質評価を可能とする技術の開発を目標としました。CYPを誘導する薬剤を添加した肝細胞を観察したところ、酸化型CYP酵素群をラマン散乱により検出できること、また、その信号がCYPの酵素活性と相関を示すことを発見しました。図1aは、CYP酵素群の誘導剤であるリファンピシンを添加しCYPの発現を「誘導」した肝細胞(HepaRG)、およびリファンピシンを添加していない「対照(コントロール)」の肝細胞のラマン散乱スペクトルを比較した結果です。リファンピシンによるCYPの発現誘導の結果により、酸化型CYPの分子数を示す1370 cm-1と1636 cm-1の信号が増加することが確認できます。図1bは、図1aのスペクトルを用いて、波数ごとに細胞画像を構築したラマン散乱像です。CYP(1370 cm-1と1636 cm-1)は酸化型CYPのラマン信号を画像化しています。リファンピシンを添加していない対照の肝細胞画像では、酸化型CYPの分子数を示す1370 cm-1と1636 cm-1の信号がほとんど観察されません。一方で、リファンピシンを添加すると、1370 cm-1と1636 cm-1の信号が細胞内で増加していることが分かります。図1c、d、eは、それぞれCYPで最も多く発現するCYP3A4の免疫染色、CYP3A4活性、CYP3A4のウエスタンブロットの結果を示しており、これらの結果は図1bの酸化型CYPの分子数を示す1370 cm-1と1636 cm-1のラマン信号と相関することが分かります。
図1. リファンピシン添加による肝細胞(HepaRG)中のCYP発現誘導
図中記載の「誘導」は、リファンピシンを添加しCYPの発現を誘導した細胞、「対照(Control)」は、リファンピシンの添加をしていない細胞。a. 「誘導」した肝細胞と「対照」となる肝細胞のラマンスペクトルの比較。右上の2枚の差し込み図は、1370 cm-1および1636 cm-1付近のスペクトルの拡大図。b. 「誘導」した肝細胞と「対照」となる肝細胞の細胞内分子イメージングによる比較。Cyt c(600 cm-1)はシトクロムc、Cyt b5(675 cm-1)はシトクロムb5、Phenyl.(1000 cm-1)はフェニルアラニン、CYP(1370 cm-1と1636 cm-1)は酸化型CYPのラマン信号を画像化。c. 「誘導」した肝細胞と「対照」となる肝細胞の免疫染色像の比較。左から順に青色蛍光物質(DAPI)により染色された細胞核(Nuclei)、赤色蛍光物質(Alexa 594)により染色された細胞内のシトクロムb5(Cyt b5)、緑色蛍光物質(Alexa 488)により染色された細胞内のCYP3A4を示しており、右端は、左側3つの画像の合成像(Merge)。d. 「誘導」した肝細胞と「対照」となる肝細胞における化学発光測定法を用いたCYP3A4活性の比較。e. 「誘導」した肝細胞と「対照」となる肝細胞におけるタンパク質の発現量の比較。肝細胞から細胞抽出物を取得し、CYP3A4、シトクロムc(Cyt c)、シトクロムb5(Cyt b5)、βアクチン(β-actin)のタンパク量をウエスタンブロットにより定量。
上記の結果だけでは、酸化型CYPの分子数を示す1370 cm-1と1636 cm-1のラマン信号が、CYPの総分子数に相関しているのか、CYP活性に相関しているのかを確定することができないため、これを確かめる目的で次の実験を実施しました。メカニズムベース阻害剤(MBI)であるアザムリンはCYP3A4を含むCYP3A酵素群を不活化することで知られています。不活化されたCYP3A4分子は細胞内にとどまるためCYP3A4の分子数は変化しないと期待されます。図2aは、アザムリンを添加または無添加の肝細胞(HepaRG)について、波数ごとに細胞画像を構築したラマン散乱像です。図中記載のCYP(1370 cm-1と1636 cm-1)は、酸化型CYPのラマン信号を画像化しています。アザムリンを添加することで1370 cm-1と1636 cm-1の信号の強度が低下していることが分かります。一方で、CYPの分子数を測定するため、免疫染色を行ったところ全CYPの大半を占めるCYP3A4の減少は、ほとんど確認できませんでした(図2b)。この結果は、酸化型CYPの分子数を示す1370 cm-1と1636 cm-1の信号強度とCYPの総分子数に相関せず、CYPの活性に相関していることを示しています。
図2. アザムリン添加による肝細胞(HepaRG)中のCYP3A4の活性阻害
a.アザムリンの添加/不添加の肝細胞(HepaRG)のラマンスペクトルの比較。Cyt c(600 cm-1)はシトクロムc、Cyt b5(675 cm-1)はシトクロムb5、CYP(1370 cm-1と1636 cm-1)は酸化型CYPのラマン信号を画像化。b. アザムリンの添加/不添加の肝細胞の免疫染色像の比較。免疫染色赤色蛍光物質(Alexa 594)により染色された細胞内のシトクロムb5および緑色蛍光物質(Alexa 488)により染色された細胞内のCYP3A4。
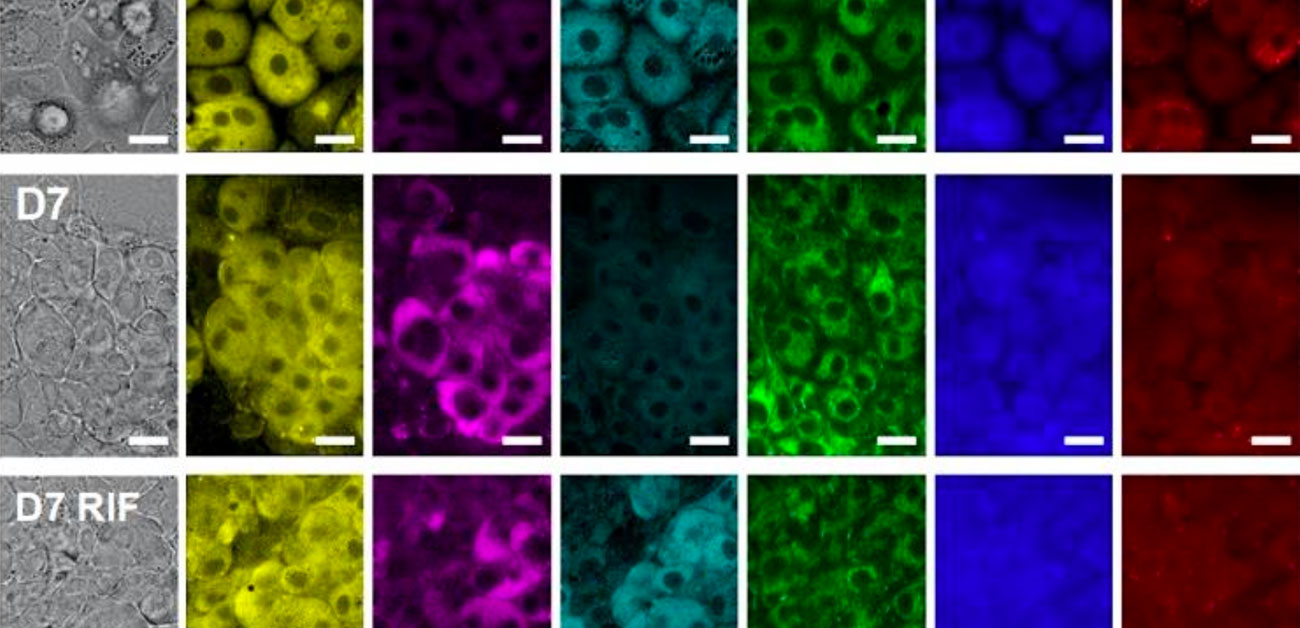
CYPは肝細胞において薬物や毒物の代謝に重要な役割を担っていることから、CYP活性と相関するラマン信号(1636 cm-1)とグリコーゲン(940 cm-1)、フェニルアラニン(1000 cm-1)、脂質(1450 cm-1)といった他の肝代謝を示す生体分子信号の同時検出を試みました(図3)。細胞では、フェニルアラニンの信号は、細胞のタンパク質量と相関することが知られています。肝細胞(HepaRG)を7日間培養し肝細胞の成熟を促し、CYPを誘導するリファンピシンを添加した場合と添加しない場合を比較したところ、グリコーゲンの信号がCYPの信号と逆相関することが明らかになりました。この結果はCYPの活性化とグリコーゲン分解による糖新生が密接に関係している可能性を示しています。
図3. 7日間培養した肝細胞(HepaRG)の細胞におけるリファンピシン(RIF)の添加/不添加の影響を細胞内分子イメージングで比較
D0は培養0日目、D7は培養7日目、D7 RIFは、5日目にリファンピシンを添加しCYPを誘導した培養7日目の肝細胞。それぞれの培養日数において、明視野像(Brightfield)、シトクロムb5(675 cm-1、Cyt b5)、グリコーゲン(940 cm-1、Glycogen)、酸化型CYP/CYP活性(1636 cm-1、CYPs)、シトクロムc(600 cm-1、Cyt c)、フェニルアラニン(1000 cm-1、Phenyl.)、脂質(1450 cm-1、Lipids)を撮影。
これらの結果は、光を当てるだけで無標識の細胞や組織から、非破壊的に生体分子情報を取得でき、細胞や組織の状態を把握できることを示しています。また、細胞ひとつひとつの代謝分子の量やCYP活性を測定できるため、従来の手法とは異なり、不均一な細胞集団の個々の細胞応答を測定することが可能です。本技術は肝細胞の品質管理や創薬開発における肝代謝評価に応用が可能です。
※本プレスリリースの「概要図、図1、図2、図3」は、原論文「図3、図1、図4、図5」を引用・改変したものを使用しています。
今後の予定
今後は、本研究成果を活用した肝臓分化や成熟状態の測定技術を解析ソフトウェアとして確立し、ラマン分光を活用した肝細胞品質管理や創薬開発用の医療支援機器として社会実装することを目指して研究開発に取り組む予定です。また、ラマン分光技術やラマン顕微鏡技術は、光を当てることで無標識かつ非破壊的に細胞や組織内の生体分子情報を取得できるため、生体情報に基づいた病気の診断、がん細胞の有無の診断、再生医療等製品の品質管理など、さまざまな医療支援技術として役立てられると考えています。他の臓器や細胞と対象とした疾病診断や細胞品質管理技術の開発に取り組み、「健康不安なく人生を楽しむヘルスケア社会の実現」を目指します。
論文情報
掲載誌:Communications Biology
論文タイトル:Label-free chemical imaging of cytochrome P450 activity by Raman microscopy
著者:Menglu Li, Yasunori Nawa, Seiichi Ishida, Yasunari Kanda, Satoshi Fujita*, Katsumasa Fujita*
DOI:10.1038/s42003-022-03713-1
用語説明
- 薬物代謝酵素(CYP)
細菌や植物,哺乳動物に至るほとんどすべての生物に存在します。全生物では700種類以上、ヒトでは50種類程度の分子種が報告されています。薬物や毒物の代謝において重要な役割を果たす酸化酵素です。還元状態で450 nmに吸収極大を示すため、シトクロムP450(P450)とも呼ばれます。
- 肝細胞(肝実質細胞)
肝臓を形成する細胞で、肝臓の実質的な機能(糖新生、代謝、解毒など)を担う細胞を指します。実際には肝臓には肝細胞の他にクッパ細胞、星細胞、類洞内皮細胞などが存在するため、単に肝細胞と呼称すると他の肝臓の細胞と混同する恐れがあり、区別を明確に表現する際には肝実質細胞と呼ぶこともあります。
- リファンピシン
抗生物質の一種。CYP3A4をはじめとして、いくつかのCYPの発現を誘導することで知られます。
- ラマン散乱
対象となる物質に光を照射したとき、散乱する光の中に照射した光の波長と異なる波長をもつ散乱光が含まれる現象。ラマン散乱における波長の変化は物質の分子振動に起因するため、波長の変化を測定することで対象物質の分子組成を知ることができます。
- 小腸上皮細胞
小腸の上皮を形成する細胞。上皮細胞とは、体、体腔などの表面を覆い外側と内側を隔てるバリアを形成する細胞。
- 薬物有害反応(ADR)
薬物の主作用に関連しない薬理反応(副作用)の内、好ましくない反応を指します。
- エンドポイント測定
対象となるサンプルに反応試薬などを添加し、一定の反応時間が経過した後、サンプルの蛍光・発光・吸収などの測定する手法。エンドポイント測定では、細胞等のサンプルを破壊して測定することになるため、細胞内の反応分布や経時的な計測ができません。
- ラインスキャン
レーザーをライン状に加工し対象物を「線」で走査する手法。開発したラマン顕微鏡では、走査を「点」ではなく「線」単位で行うことで高速化しています。
- HepaRG
フランス国立衛生医学研究所で樹立されたヒト由来肝細胞株であり、ヒト肝細胞特異的な機能を保持しています。CYP1A2、CYP2B6、CYP3A4の発現量がヒト初代肝細胞と同レベルであることが知られており、ヒト初代肝細胞の代替として薬物動態、毒性試験、薬理試験などに広く利用されています。
- CYP3A4
CYP酵素群に属する酵素であり、ヒトの肝臓に存在するCYPのうちの大部分を占めます。リファンピシンにより発現の誘導を受けることが知られています。
- 免疫染色
サンプル中に含まれるターゲット(抗原)となるタンパク質に特異的に結合する抗体を用いてターゲットを可視化する手法。抗体側に予め蛍光物質などを付加させることでターゲットの分布を可視化できます。
- ウエスタンブロット
電気泳動で分離したタンパク質をメンブレン(膜)に転写した後、抗体などを利用して目的のタンパク質のみを検出する手法。
- メカニズムベース阻害剤(MBI)
酵素活性を不可逆的に阻害する物質。阻害剤は活性部位に結合し、そこで酵素により修飾されて反応性基が生成され、不可逆的に反応して安定な阻害剤-酵素複合体を形成します。
- アザムリン
抗生物質の一種。CYP3A4のメカニズムベース阻害剤(MBI)として知られています。
