老化研究の新モデル “超速成長・超速老化魚ターコイズキリフィッシュ” の遺伝子機能高速解析系を開発
ヒト老化研究の加速に期待
研究成果のポイント
- 飼育可能な脊椎動物の中で最短の寿命をもつターコイズキリフィッシュは、ヒト老化メカニズムの解析やアンチエイジング因子の評価を短期間で行える新たなモデル動物として注目され始めているが、遺伝子機能を解析する技術が十分に確立されていなかった。
- 研究チームは、最新のゲノム編集技術CRISPR/Cas9法を応用して、高効率かつ短期間で遺伝子改変ターコイズキリフィッシュを作製する技術を開発した。
- 今回確立した高速解析系により、脊椎動物の老化メカニズムの解析やアンチエイジング因子の評価を短期間で実行することが可能になり、今後の老化研究の加速が大いに期待される。
概要
大阪大学微生物病研究所の石谷太教授、荻沼政之助教、理学研究科修士2年西田萌那さんらの研究チームは、ヒト老化研究の新たなモデル動物である“ターコイズキリフィッシュ”の遺伝子機能高速解析系の開発に成功しました。
近年の老化研究の加速度的な発展により、老化制御因子やアンチエイジング因子の候補が次々と報告されています。しかし、これらが真に老化・抗老化に関わる因子であることを実証するためには、実験動物においてこれら因子の量や活性を人為的に変化させて老化が抑制されること(健康寿命が延伸すること)を示し、さらにその作用メカニズムを解明する必要があります。
これまで、このような老化解析は、代表的なモデル動物であるマウスやゼブラフィッシュ、線虫、ショウジョウバエなどを用いて解析が行われてきました。しかし、マウスやゼブラフィッシュは元々の寿命が長く(図1)、老化しにくいため、老化解析に膨大な時間がかかるという問題がありました。また、線虫やショウジョウバエは寿命が短いため(図1)、老化解析を短期間で行えるという利点がありますが、無脊椎動物であるためヒトとは体の構造が大きく異なり、ヒト老化モデルとしては不十分です。
このような課題を受け、新たな老化研究モデルとして、ターコイズキリフィッシュ(学名Nothobranchius furzeri)が注目されています。ターコイズキリフィッシュのGRZ系統(ジンバブエGona‐Re‐Zhou国立公園から採取された)は孵化後1ヶ月以内に性成熟し、その後2、3ヶ月で急速に老化して死に至る“超速成長・超速老化”という特徴を持ちます。このGRZ系統の寿命の短さは、研究室で飼育可能な脊椎動物の中で最短であり、短期間での老化解析を実現する魅力的なモデル動物として近年注目を集めつつあります。しかしながら、ターコイズキリフィッシュの遺伝子機能を解析する技術の開発はあまり進んでおらず、遺伝子組換えされたターコイズキリフィッシュは未だ指折り数えるほどしか報告されていません。そこで、研究チームは、最新のゲノム編集技術CRISPR/Cas9を応用して、任意の遺伝子を破壊あるいはその発現動態を可視化したターコイズキリフィッシュ個体を高効率かつ短期間で製する技術を開発しました。今回確立した高速遺伝子解析技術により、脊椎動物の老化メカニズムの解析やアンチエイジングファクターの評価を短期間で実行することが可能になり、今後の老化研究の加速が大いに期待できます。
本研究成果は、2022年7月8日(金)に、英国科学誌「サイエンティフィックリポーツ」に掲載されました。
図1. 新たな老化モデル:超速成長・超速老化魚ターコイズキリフィッシュ
研究の背景
老化研究について:
近年、医療や食糧生産の技術向上によって平均寿命は年々延びつつありますが、その一方で、社会の高齢化による働き手の減少や、要介護者増加による負担の増加といった新たな問題が生じており、これらを解決するために、加齢に伴う機能低下を防ぎ、健康寿命を延伸する技術が求められています。
このようなアンチエイジング技術の確立を目指し、世界の研究者からさまざまな角度からアンチエイジング因子の探索や老化メカニズム解析を進めています。例えば、ヒトの長寿者や、ゾウやコウモリ、ハダカデバネズミなどの長寿動物の培養細胞やゲノム情報を解析することで長寿の要因を探る比較老化生物学的アプローチが盛んに行われ、アンチエイジング因子候補が多数見出されています。しかしながら、こうした候補因子が真に動物において老化を抑制する因子であるかを証明するためには、モデル動物においてこれらの因子を機能改変して老化抑制効果を検証する必要があります。
こうしたことから、線虫やショウジョウバエなどモデル無脊椎動物やマウスなどモデル脊椎動物を用いた候補因子の機能解析が行われています。しかし、上述のように、モデル無脊椎動物は、寿命が短く簡便に解析できるという利点を持つものの体の構造がヒトとは大きく異なり、ヒト老化モデルとしては不十分であり、一方で、マウスはその寿命は3年程度でありヒトよりは寿命が短いものの、老化・寿命制御機構を研究するには膨大な時間が必要、という短所がありました。
そこで、研究グループは、超速成長・超速老化する小型魚類ターコイズキリフィッシュ(通称キリフィッシュ; 学名Nothobranchius furzeri)に注目しました。この魚は、飼育可能な脊椎動物の中で最も寿命が短く、ヒトと類似した老化の表現型(運動能力や繁殖力、認知機能の低下、臓器の萎縮や変性など)を示します(Valenzano et al. Cell. 2015など)。しかし、飼育・繁殖が難しいことから、世界的にもこの魚を使う研究者の数は極めて少ない状況です。
研究グループは、ターコイズキリフィッシュGRZ系統を用いた老化研究を先行して進めているドイツマックスプランク研究所を訪問し、その卵を譲り受け、数年がかりでその大規模・飼育繁殖系の確立を進めてきました。
遺伝子組み換え技術について:
動物個体において特定の遺伝子がいつどこでどのように機能するかを調べるためには、代表的な方法が二つあります。一つは、レポーターを使った遺伝子発現の可視化です。この方法では、任意の遺伝子発現をGFPなどの蛍光レポーターの発現に変換することで、その遺伝子がいつどの細胞でどの程度の強さで発現するかを調べることができます。
もう一つの方法は、遺伝子の機能改変です。この方法では、任意の遺伝子を破壊(ノックアウト法 ※4)あるいは遺伝子配列を編集した個体の表現型を調べることで、その遺伝子の機能を調べることができます。しかし、ターコイズキリフィッシュは既存のモデル魚類であるゼブラフィッシュやメダカより卵や幼魚の扱いが難しく、また卵が硬い殻に覆われていることもあり、遺伝子改変技術の開発が進んでいませんでした。また、従来のCRISPR/Cas9を用いた遺伝子改変では、1つの遺伝子に対して1ヶ所のsgRNAを設計してこれをCas9と共に受精卵に導入することで対立遺伝子の一つに変異を低頻度で導入し、それを育てて交配を繰り返すことで初めて両方の対立遺伝子に変異が入ったノックアウト個体が得られるため、解析に至るまでには多大な時間と労力が必要でした(図2上段)。
図2. ターコイズキリフィッシュの高効率・高速遺伝子破壊法
研究の内容
研究チームはターコイズキリフィッシュの遺伝子破壊を高効率かつ高速で行うために、理化学研究所のグループがマウスを対象にして開発した手法を参考にしました。その手法とは、1つの遺伝子に対して3ヶ所のsgRNAを設計することで両方の対立遺伝子に同時に変異を導入し、これにより1世代目でも効率良くノックアウト個体を得ることができる、という技術です(Sunagawa et al., Cell Rep 2015)。
研究グループはこの技術を参考に、ターコイズキリフィッシュにおいて1遺伝子に3ヶ所のsgRNAを設計し、遺伝子の種類に関係なく高確率(ほぼ100%)で短時間のうちに遺伝子ノックアウト個体を得る手法を開発しました。実際、この手法を用いて、三種類の遺伝子をそれぞれにほぼ100%の効率で破壊することに成功しました(図3)。
つまり、これまでゲノム編集処理を施した個体の孫の世代まで育てないと行えなかった遺伝子機能解析を、ゲノム編集処理を施した個体そのものですぐに解析することができるようになりました。
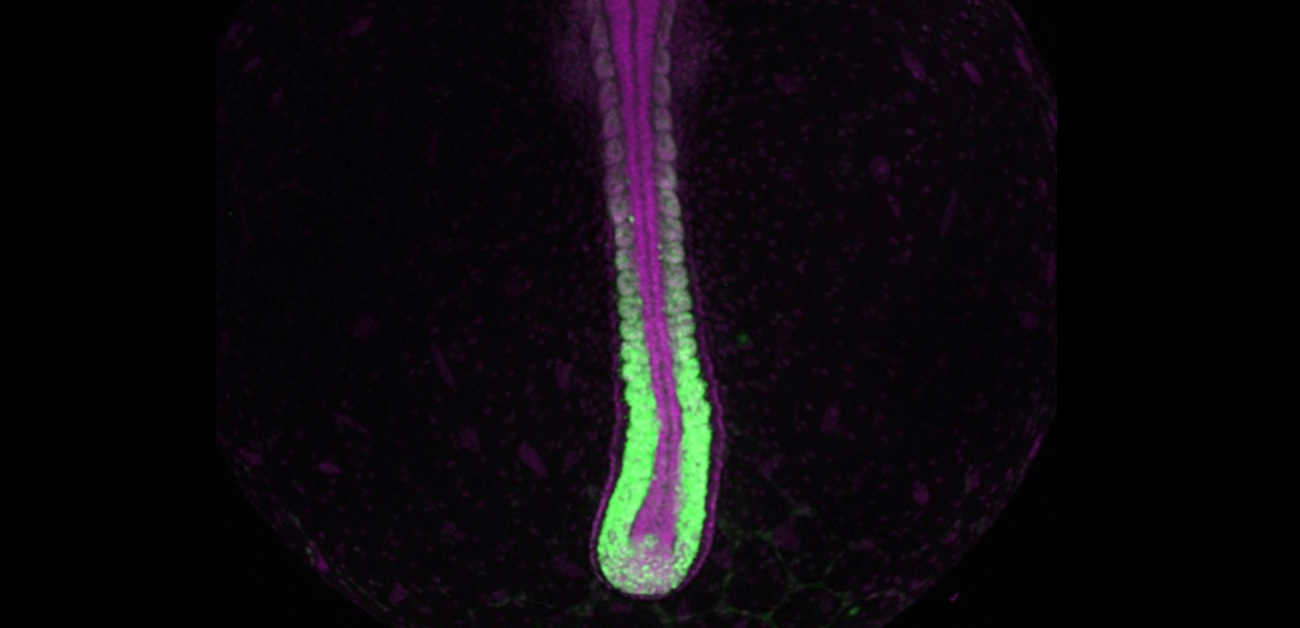
また、研究グループは、高効率で蛍光レポーターを導入する手法も作製しました。基礎生物学研究所のグループが小型魚類ゼブラフィッシュを対象に開発した手法(Kimura et al., Sci Rep 2014)を活用することで、蛍光レポーターをCRISPR/Cas9を応用してターコイズキリフィッシュの任意の遺伝子領域に高効率でノックインすることに成功しました。この手法の効率は非常に高く、レポーターを導入した1世代目でも遺伝子の発現を追跡することが十分に可能でした(図4)。
以上、本研究では、ヒト老化研究の新たなモデル動物であるターコイズキリフィッシュの高速・高効率遺伝子破壊法・遺伝子発現可視化法の開発に成功しました。言わば、「老化メカニズム高速解析プラットホーム」の開発に成功しました。今回確立した高速解析プラットホームにより、老化関連因子候補、アンチエイジング因子候補の機能解析を短期間で高効率に行うことが可能になり、今後の老化研究の加速が大いに期待されます。
図3. 遺伝子ノックアウトターコイズキリフィッシュ
図4. Tbx16遺伝子の発現動態を可視化したターコイズキリフィッシュ
本研究成果が社会に与える影響(本研究成果の意義)
老化研究に対する社会的なニーズは高まっているにも関わらず、既存のモデル脊椎動物の老化速度の遅さゆえに老化メカニズムの理解はあまり進んでいません。本研究により、新たなヒト老化研究モデル動物である超速老化魚ターコイズキリフィッシュの高効率・高速遺伝子機能解析法が確立されたことにより、今後、老化研究が著しく加速することが予想されます。本研究室でも、この新手法を大いに活用し、ヒト老化メカニズムの解明を目指していきます。
特記事項
本研究成果は、英国科学誌「サイエンティフィックリポーツ」に2022年7月8日に公開されました。
タイトル:“Rapid reverse genetics systems for Nothobranchius furzeri, a suitable model organism to study vertebrate aging”
著者名:Masayuki Oginuma, Moana Nishida, Tomomi Ohmura-Adachi, Kota Abe, Shohei Ogamino, Chihiro Mogi, Hideaki Matsui, Tohru Ishitani
なお、本研究は、日本医療研究開発機構AMED老化プロジェクト、公益財団法人武田科学振興財団研究助成、公益財団法人 三菱財団、公益財団法人公益財団法人 小野医学研究財団、公益財団法人 長瀬科学技術振興財団、JST創発、科学研究費補助金などの支援を受け、実施されました。
図5. ターコイズキリフィッシュの生活環
参考URL
微生物病研究所生体統御分野
https://ishitani-lab.biken.osaka-u.ac.jp
用語説明
- ターコイズキリフィッシュ
アフリカの乾燥地帯に生息する年魚で、乾燥地帯特有の雨季・乾季の気候サイクルを生き延びるために短命化したと言われています(図5)。雨季に発生する小さな池の中で孵化して1ヶ月以内に性成熟して産卵し、その後、短期間に徐々に老化して死に至ります(サケのように産卵直後に死ぬのではなく、老化プロセスを経て死にます)。乾季になると池は干上がりますが、ターコイズキリフィッシュは能動的に生命活動を休止して休眠状態に入り、土の上で乾季を乗り越えます。休眠はその後の生命活動に何ら負の影響を与えないことがわかっており、次の雨季には発生を再開し天寿を全うします。なお、ターコイズキリフィッシュは日本語に直訳すると、メダカ、川魚、となりますが、実際の種としては、メダカがダツ目であるのに対し、ターコイズキリフィッシュはカダヤシ目になります。
- CRISPR/Cas9法
CRISPR/Cas9法とはDNAの二本鎖を任意の場所で切断して特定の配列を削除したり、新たな配列と置換することができる新しい遺伝子改変技術です。標的となるゲノム配列と相補的なガイドRNA(sgRNA)を設計して細胞内に導入し、それをCas9タンパクが認識して切断することで遺伝子を編集します。
- レポーターを使った遺伝子発現可視化
任意の遺伝子発現をGFPなどの蛍光レポーターの発現に変換することで、その遺伝子がいつどの細胞でどの程度の強さで発現するかを調べることを可能にする手法。
- ノックアウト法
目的の遺伝子の機能を欠失させる、遺伝学的解析手法であり、機能が未知の遺伝子を研究する際に行われ、ノックアウト個体と野生型を比較解析することによって、遺伝子の機能を推測します。
遺伝子は2つ組の対立遺伝子が存在しており、初めに対立遺伝子のうち一つに変異を導入した個体を作製しこれらを掛け合わせることによって、両方の対立遺伝子に変異が入ったノックアウト個体を得ることが可能です。CRISPR/Cas9法を用いることで、簡便にノックアウト個体が得られるようになってきました。
