
日本人特有の難病「脊髄小脳失調症31型」の治療へ道開く
RNA毒性を緩和する低分子化合物を発見
研究成果のポイント
- 難治性の神経変性疾患、脊髄小脳失調症31型(SCA31)の治療につながる低分子化合物を世界で初めて発見
- SCA31は、日本人に特有の常染色体優性の脊髄小脳変性症で日本国内には2000〜4000人ほどの患者がいると考えられています。
- 疾患原因となるリピートRNAとタンパク質の凝集体形成を低分子化合物が阻害
- ショウジョウバエモデルで、複眼変性の緩和を確認
- 核酸を標的とする低分子化合物が創薬開発に有効であることを改めて実証
- 核酸標的低分子創薬における我が国の卓越した研究力を実証
概要
大阪大学産業科学研究所の柴田知範助教、中谷和彦教授(現:理事・副学長)らの研究グループは、大学院医学系研究科の永井義隆寄附講座教授(神経難病認知症探索治療学寄附講座、現:近畿大学医学部主任教授)、大学院生命機能研究科の廣瀬哲郎教授、千葉工業大学先進工学研究科の河合剛太教授、東京医科歯科大学医学部附属病院 長寿・健康人生推進センターの石川欽也教授らとの共同研究で、日本人特有の神経難病であるSCA31のRNA毒性を緩和する低分子を世界で初めて発見しました。SCA31は、UGGAAという5塩基の繰り返し配列(リピート)を持つRNAが、細胞内のタンパク質と凝集体(RNA foci)を形成すること(RNA毒性)により、発症する神経変性疾患です。SCA31の治療法開発においてUGGAAリピートRNAが重要な標的と考えられていましたが、これまでこのRNAに結合する低分子は見つかっていませんでした。
今回、柴田助教、中谷教授らの研究グループは、開発した低分子ナフチリジンカーバメートダイマー(NCD) が、UGGAAリピートRNAに結合すること、NCDとRNAの複合体の三次元構造、そして、SCA31のショウジョウバエモデルにおいて、RNA毒性を緩和することを見出しました。本研究成果である、SCA31の原因となるUGGAAリピートRNAに結合する低分子の発見により、SCA31の治療開発への道がひらけました。
現在、世界中の創薬企業が核酸(DNA、RNA)を標的とした低分子創薬を開始していますが、本研究では、低分子化合物の創成、低分子とRNA複合体形成の詳細、その三次元構造の解析、細胞内の挙動、そして、個体での活性評価のすべてを日本の研究者が結集して達成し、本研究領域における我が国の研究力が卓越していることを示しており、我が国における核酸を標的とした低分子創薬研究のさらなる加速が期待されます。
本研究成果は、英国科学誌「Nature Communications」に、1月11日(月)午後7時(日本時間)に公開されました。
研究の背景
脊髄小脳失調症31型(SCA31)は、日本人に特有の常染色体優性の脊髄小脳変性症で日本国内には2000〜4000人ほどの患者がいると考えられています。2009年に東京医科歯科大学の石川教授らにより、SCA31の原因がTGGAAというDNAの5塩基の繰り返し配列(リピート)であり、このDNAから転写されるUGGAAリピートRNAが神経細胞核内にRNA fociと呼ばれる異常な凝集体を形成することが報告されました。また2017年には、大阪大学大学院医学系研究科の永井寄附講座教授と東京医科歯科大学の石川教授らのグループがSCA31モデルショウジョウバエを用いた研究から、SCA31がUGGAAリピートRNAの毒性により起こることを明らかにしました。これらの先行研究によりUGGAAリピートRNAがSCA31の治療開発における重要な標的であると考えられていましたが、UGGAAリピートRNAに結合する低分子化合物はこれまでに見出されていませんでした。
大阪大学産業科学研究所の中谷教授らは、核酸塩基を水素結合により認識する核酸標的低分子に関する研究を推進し、ハンチントン病や脆弱X症候群などの原因となる繰り返し配列を持つ核酸を標的とするリピート結合低分子などを見出していました。
本研究の成果
本研究グループは、これまでに独自に開発してきたリピート結合低分子を含む化合物ライブラリを用いてUGGAAリピートRNA結合低分子の探索を行い、NCDを見出しました。RNAとNCDの複合体構造を核磁気共鳴分光法により解析したところ、NCDがUGGAA配列中のグアニンを水素結合により認識してRNAに結合していることが明らかになりました(図1)。またNCDが、UGGAAリピートRNAとタンパク質との結合や細胞内におけるRNA fociの形成を阻害すること(図2A, B)、さらにはSCA31モデルショウジョウバエにおいてUGGAAリピートRNAの毒性(複眼変性)を緩和することを確認しました(図2C)。
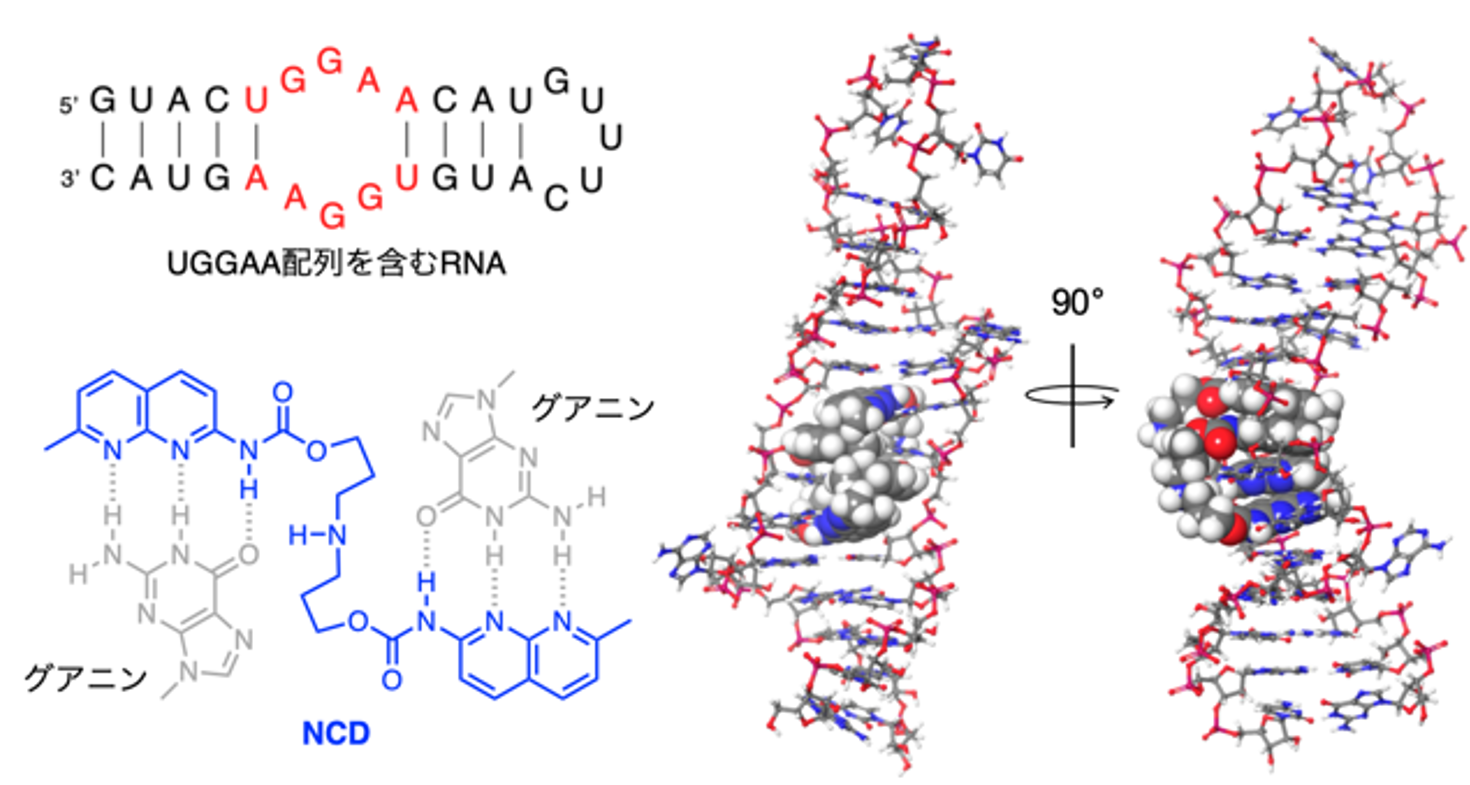
図1 NCD-RNA複合体構造
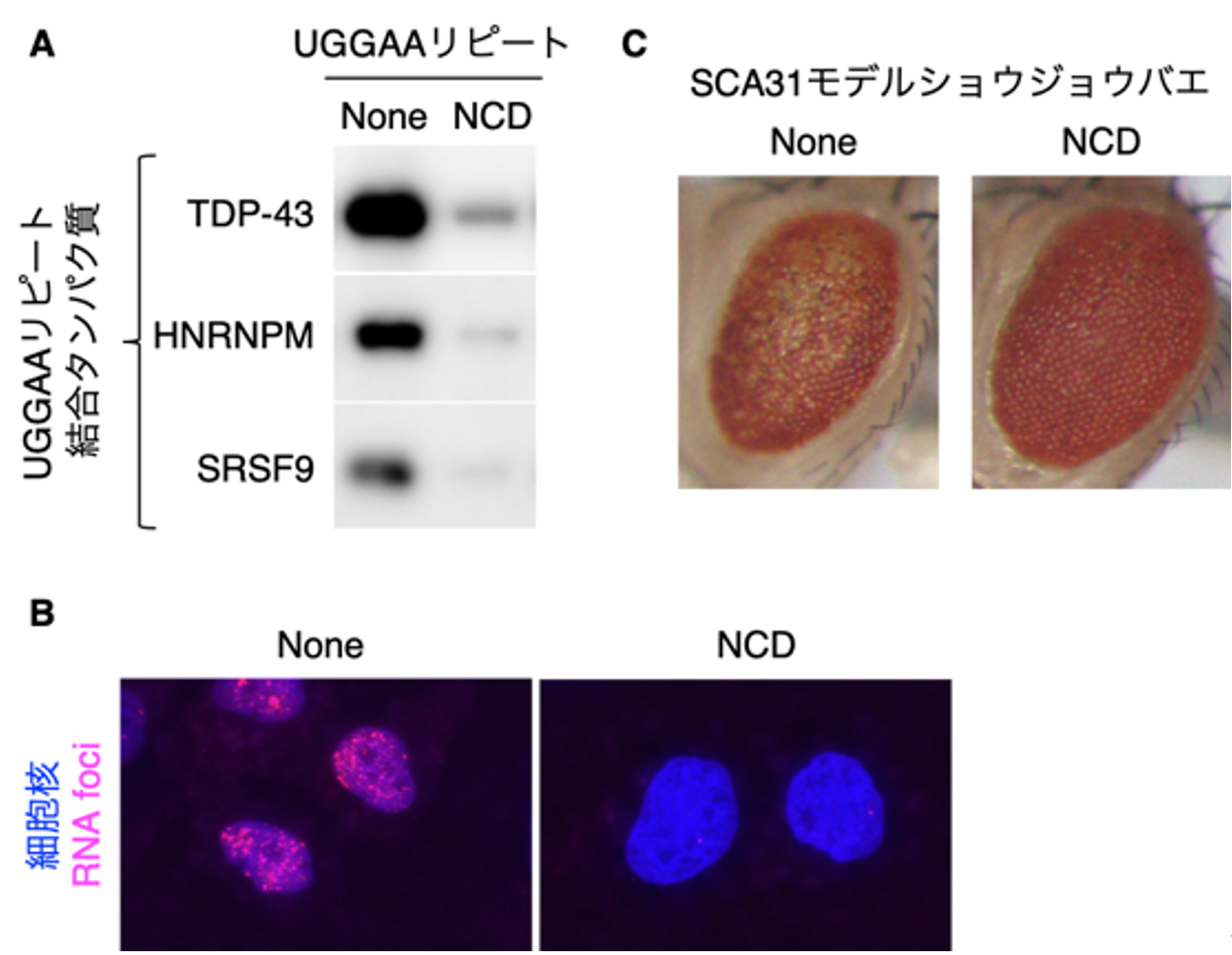
図2 NCD による(A)RNA-タンパク質相互作用、(B)RNA fociに対する阻害効果及び(C)SCA31モデルショウジョウバエにおける複眼変性の緩和
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、UGGAAリピートRNA標的低分子によるSCA31の治療開発への可能性が示されました。リピートRNAは、筋強直性ジストロフィー、脆弱X関連振戦/失調症候群、SCA、筋萎縮性側索硬化症などの神経難病の原因として知られており、リピートRNAを標的とした核酸標的低分子創薬にも期待がもてます。
特記事項
本研究成果は、2021年1月11日(月)午後7時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
【タイトル】“Small molecule targeting r(UGGAA)n disrupts RNA foci and alleviates disease phenotype in Drosophila model”
【著者名】Tomonori Shibata,1 Konami Nagano,2 Morio Ueyama,3 Kensuke Ninomiya,4 Tetsuro Hirose,4,5 Yoshitaka Nagai,3 Kinya Ishikawa,6 Gota Kawai,2 and Kazuhiko Nakatani1
DOI:10.1038/s41467-020-20487-4
【所属】
1. 大阪大学 産業科学研究所 精密制御化学研究分野
2. 千葉工業大学 先進工学研究科 生命科学専攻
3. 大阪大学 大学院医学系研究科 神経難病認知症探索治療学寄附講座
4. 大阪大学 大学院生命機能研究科
5. 北海道大学 遺伝子病制御研究所
6. 東京医科歯科大学医学部附属病院 長寿・健康人生推進センター
なお、本研究は、JSPS科学研究費助成事業特別推進研究・基盤研究の一環として行われました。
参考URL
産業科学研究所 中谷研究室HP
https://www.sanken.osaka-u.ac.jp/labs/rbc/index.html
用語説明
- 脊髄小脳失調症31型(SCA31)
TGGAAの5塩基の繰り返し配列が原因で起こる遺伝性の神経変性疾患(脊髄小脳変性症)で、SCA31患者は、16番染色体のBEAN1遺伝子イントロンにTGGAAリピートが存在する。TGGAAリピートから転写されるUGGAAリピートRNAが関与するRNA介在性の神経変性疾患である。手足の震え、歩行時のふらつき、呂律が回らないなどの運動失調を症状とする神経難病で、現在のところ根本的な治療法はありません。
- ナフチリジンカーバメートダイマー(NCD)
グアニン(G)と相補的な水素結合可能な2-アミノ-1,8-ナフチリジン骨格をリンカーで繋いだ核酸標的低分子。DNA中のG-Gミスマッチ塩基を認識する分子として設計された分子で、脆弱X症候群の原因となるCGGリピートDNAに結合することが分かっている。
- SCA31モデルショウジョウバエ
SCA31の原因となるTGGAAリピートDNAを導入した疾患モデルショウジョウバエ。導入されたTGGAAリピートから転写されるUGGAAリピートRNAの毒性により進行性の運動障害や複眼変性などを生じる。本研究で使用したショウジョウバエは、UGGAAリピートRNAの毒性により、複眼の面積減少や色素脱失などの複眼変性を引き起こす。
