血管新生のバランスを保つ抑制因子、その制御メカニズムを解明
がんの悪性化や血管疾患の治療につながる成果
研究成果のポイント
・強力な血管新生抑制因子である色素上皮由来因子(PEDF) が、コラーゲンの分子間架橋 形成を介して活性制御を受けるメカニズムを解明した。
・血管新生は、損傷治癒など生体組織の恒常性維持に必須のプロセスで、通常は、促進因子と抑制因子の均衡が保たれることで厳密に制御されている。しかし、その均衡が崩れ、促進因子が過剰になると、線維症や動脈硬化症、腫瘍の悪性化など様々な疾患に関与することから、詳細な制御メカニズムについて多大な関心が寄せられている。特に、抑制因子のメカニズムは不明な点が多かった。
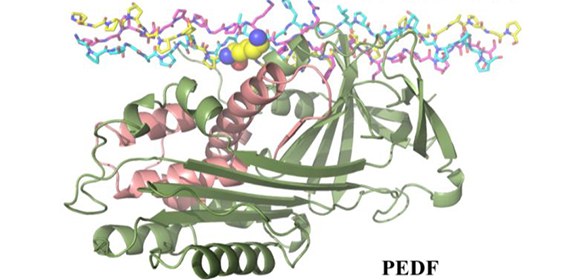
・血管新生の際、促進因子の刺激を受けた血管内皮細胞は周囲のコラーゲンをリモデリングしながら発芽する。PEDFは、この際に新規に合成されたコラーゲンに結合し、新生血管にだけ作用することを構造生物学的手法により解明した。
・がん、線維症、動脈硬化、網膜症など、血管新生が関与する疾患の治療法の開発へ期待が高まる。
概要
大阪大学大学院薬学研究科の河原一樹助教、吉田卓也准教授、大久保忠恭教授、大阪大学大学院工学研究科の小林祐次招へい教授、早稲田大学先進理工学研究科の小出隆規教授らの研究グループは、強力な血管新生抑制因子である色素上皮由来因子(Pigment epithelium-derived factor: PEDF)の活性が、細胞外マトリックスのリモデリングにより時空間的に制御される構造基盤を明らかにしました。
血管新生は、促進因子と抑制因子のバランスで厳密に制御されていますが、既存の血管に作用し内皮細胞の発芽を促す促進因子に比べ、新生血管選択的に作用する抑制因子の制御メカニズムについては不明な点が多く残されています。本研究では、アンジオスタチンやエンドスタチンなどよりも強力な内因性の血管新生抑制因子として知られるPEDFが、糸状仮足 の発現を伴う先端細胞 周囲に産生されたばかりのコラーゲンを標的とすることで新生血管選択的な作用を示すメカニズムを解明しました (図1) 。
この成果により、がん、線維症、動脈硬化、網膜症など、血管新生が関与する様々な疾患の治療法開発への応用が期待されます。
本研究成果は、2020年5月8日(金)(日本時間)に米国科学誌「米国科学アカデミー紀要(PNAS)」オンライン版に先行公開されました。
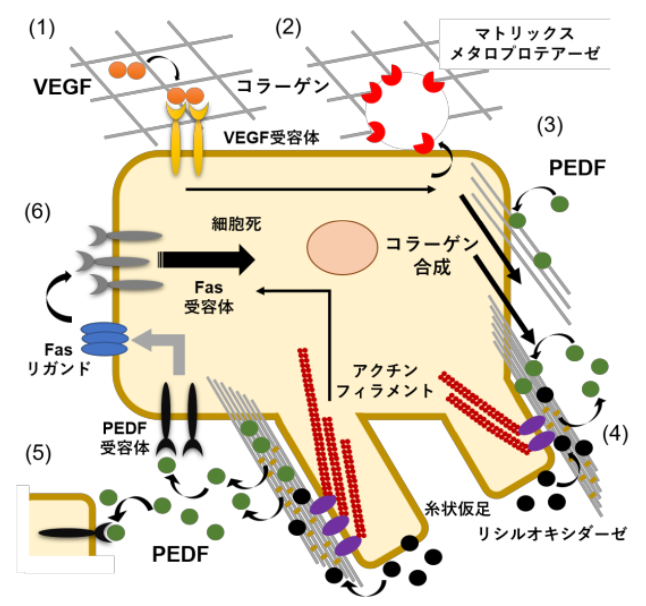
図1 細胞外マトリックスリモデリングによるPEDFの活性制御機構の概念図.
VEGFの刺激を受けた内皮細胞は(1)、マトリックスメタロプロテアーゼによるコラーゲンの分解(2)と合成(3)を行う。PEDFは、新たに合成されたコラーゲンに集積するが(4)、糸状仮足の形成とコラーゲンの成熟化(架橋形成)にともない解離する(4).その後、受容体に結合し(5)、Fas-Fasリガンド系により細胞死を誘導する(6).
研究の背景
血管新生は、損傷治癒をはじめとした生体組織の恒常性維持に必須のプロセスであり、通常は、血管新生促進因子と抑制因子の均衡が保たれることによって厳密に制御されています。しかし、その均衡が崩れ、促進因子が過剰になると、線維症や動脈硬化症、そして”治癒しない損傷組織”とも呼ばれる腫瘍の悪性化など様々な疾患に関与することから、その詳細な制御メカニズムについて、多大な関心が寄せられています。
内因性の血管新生抑制因子である色素上皮由来因子(PEDF)は、眼、皮膚、心臓、肝臓、骨など全身の多様な組織・器官で発現が認められ、アンジオスタチンやエンドスタチンよりも強力な抗血管新生作用を示すことから、現在、様々な血管疾患治療への応用が注目されている分泌タンパク質です。他の内因性の抑制因子と同様に、PEDFは、既存の血管には作用せず、新生血管選択的に作用する特徴をもつことから、副作用の少ない分子標的薬として期待されています。これまでの研究から、この抑制作用は、血管内皮細胞増殖因子(VEGF)などにより活性化された血管内皮細胞が、先端細胞へと発芽する際に、一過的に細胞表面に発現するFas と呼ばれる受容体を介した細胞死によると考えられています。しかしながら、血管新生が惹起される低酸素環境下では、促進因子が過剰に存在する一方で、抑制因子の発現が著しく低下することから、PEDFがどのように先端細胞を標的とし、細胞死を引き起こすのかは不明でした。
研究内容
本研究で、小林らの研究グループは、新生血管の発芽においてVEGFの刺激を受けた先端細胞が糸状仮足を発現し、I型コラーゲンをリモデリングしながら細胞間質に侵入することに着目し、PEDFがコラーゲンを標的とすることで血管新生の制御に関わるという作業仮説を立てました。この仮説の検証に向けて、本研究では、実験試料として取り扱いが難しい巨大で不溶性の線維を形成するコラーゲンの研究を行うため、ペプチド合成により調製可能なコラーゲンモデルペプチド をデザインし、大型放射光施設SPring-8を利用したX線結晶構造解析を実施することで、PEDFとコラーゲンの原子レベルでの結合情報を得ることに成功しました。その結果、PEDFがおよそ300回のX-Y-Glyの繰り返し配列からなるI型コラーゲンのうち、一部の領域(残基番号930‐938)を選択的に認識する構造基盤を世界で初めて明らかにすることができました (図2) 。得られた構造から、PEDFは、未成熟のコラーゲン線維でのみ露出している分子間架橋に関わるリジン残基を認識し、また、結合に伴い、PEDFの受容体結合領域が隠されてしまうことが明らかになりました。
これらのことから、PEDFが先端細胞周囲に過渡的に存在する新生コラーゲンを標的とすることが示され、また、細胞への受容体を介したシグナル伝達は、その後のコラーゲン線維の架橋形成と成熟化によって、時間的、空間的に制御を受けることも明らかになりました (図3) 。
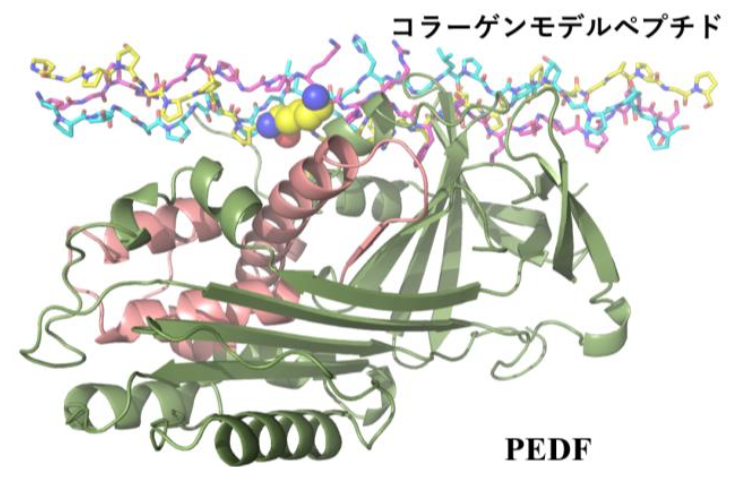
図2 PEDFとコラーゲン複合体の構造.コラーゲンの架橋に関わるリジンを黄色、PEDFの受容体結合領域をピンク色で示す。

図3 コラーゲンの分子間架橋に依存したPEDFの結合様式.
本研究成果が社会に与える影響(本研究成果の意義)
血管新生の制御は生体恒常性の維持に極めて重要です。例えば、がんの成長には栄養や酸素の供給が必要で、がん組織は新たに血管を誘導します。この血管はさらに転移の経路にもなります。その他、線維症、網膜症、動脈硬化なども血管新生に関係します。これらの治療には、血管新生促進因子や抑制因子の機能制御メカニズムに関する知識が必要不可欠であり、本研究成果はその様な治療法開発への寄与が期待されます。
特記事項
本研究成果は、2020年5月8日(金)(日本時間)に米国科学誌「米国科学アカデミー紀要(PNAS)」オンライン版に先行公開されました。
論文タイトル:“Spatiotemporal regulation of PEDF signaling by type I collagen remodeling”
著者:Kazuki Kawahara, Takuya Yoshida, Takahiro Maruno, Hiroya Oki, Tadayasu Ohkubo, Takaki Koide, Yuji Kobayashi
参考URL
大阪大学大学院薬学研究科高分子化学分野のHP
http://www.phs.osaka-u.ac.jp/homepage/b001/
用語説明
- 色素上皮由来因子(PEDF)
1991年に網膜色素上皮細胞から神経栄養作用を示す因子として単離されたセリンプロテアーゼ阻害剤(Serpin)ファミリーに属する分泌糖タンパク質。全身の多様な組織・器官で発現が認められ、神経栄養作用だけでなく、抗血管新生、抗腫瘍活性など様々な生理活性を示す多機能タンパク質として注目されている。
- コラーゲンの分子間架橋
コラーゲン分子が集合して線維を形成する際に、リジルオキシダーゼの働きにより両末端に位置するテロペプチドと配列中87、930番目の各リジン残基との間に形成される分子間架橋構造。
- 糸状仮足
運動している細胞の先端にコラーゲン等の細胞外マトリックスを足場として形成される突起状構造で、アクチンフィラメントの束からなる。
- 先端細胞
血管新生の際に血管新生促進因子の刺激を受けて血管内皮細胞から発芽する新生血管の先端に位置する細胞。糸状仮足を発現し、促進因子の濃度勾配に従って運動する。
- Fas
線維芽細胞など多くのヒト細胞株に細胞死を誘導する抗体の抗原として発見された膜タンパク質。三量体のFasリガンドと結合することで、細胞にアポトーシスを誘導する。
- コラーゲンモデルペプチド
X-Y-Glyの繰り返し配列をもち、3重らせん構造を形成するコラーゲンを模倣するペプチド。配列中の約20%を占め、三重らせん構造の安定化に寄与するプロリン(Pro)やそれが水酸化されたヒドロキシプロリン(Hyp)を含む(Pro-Pro-Gy)nや(Pro-Hyp-Gly)nが代表的であるが、(Pro-Pro/Hyp-Gly)x-(X-Y-Gly)y-(Pro-Pro/Hyp-Gly)zの様に、中央に様々な配列を組み込んだホスト-ゲスト型ペプチドも利用される。
