臓器内の全細胞を調べる革新技術
高速イメージングと高速解析で生物学・医学研究を次世代化
概要
理化学研究所(理研)生命機能科学研究センター合成生物学研究チームの上田泰己チームリーダー、松本桂彦研究員、三谷智樹研究生(大阪大学医学部附属病院医員)、堀口修平研修生らの共同研究グループは、組織透明化技術「CUBIC 」に適し、新たに開発した高速イメージング技術「MOVIE 」と高速データ解析技術により、透明化した臓器内の全ての細胞を解析する「全細胞解析」を実用化し、これを用いてマウス脳を構成する約1億個の細胞を解析することに成功しました。
本研究成果は、全細胞解析の生物学・医学分野への応用を可能にし、次世代の研究基盤になると期待できます。
あらゆる生命現象や病気の全容解明には、臓器に存在する全ての細胞一つ一つをカタログのように整理・解析する全細胞解析が不可欠です。しかし、従来法では解析に時間がかかるという難点がありました。
今回、共同研究グループは、透明化されたサンプルの3次元撮影を高速化するために、MOVIE-scan、MOVIE-skip、MOVIE-focusからなる高速イメージング技術「MOVIE」を開発し、これらを用いた高速かつ高解像な「光シート蛍光顕微鏡 (MOVIE顕微鏡)」を作製しました。その結果、透明化されたマウス全脳を従来の5分の1以下にあたる5~12時間で高解像に撮影できるようになりました。さらに、取得した画像データに対してCPUとGPU の並列計算に最適化したアルゴリズムを開発し、2~8時間での全細胞の検出・解析を可能にしました。
本研究は、英国のオンライン科学雑誌『Nature Protocols』(11月20日号)に掲載されました。

図1 臓器内の全ての細胞を調べ上げる「全細胞解析」の三つのステップ
共同研究グループ
理化学研究所 生命機能科学研究センター
合成生物学研究
チームチームリーダー 上田 泰己(うえだ ひろき)
(大阪大学 大学院医学系研究科 システム生物学 招聘教授)
(東京大学大学院 医学系研究科 機能生物学専攻 システムズ薬理学 教授)
研究員 松本 桂彦 (まつもと かつひこ)
研究生 三谷 智樹 (みたに ともき)
(大阪大学 医学部附属病院 医員)
研修生 堀口 修平 (ほりぐち しゅうへい)
テクニカルスタッフ 藤島 博史 (ふじしま ひろし)
先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信 (わたなべ とものぶ)
技師 金城 純一 (かねしろ じゅんいち)
東京大学大学院
医学系研究科
博士課程 村上 達哉 (むらかみ たつや)
情報理工系研究科
博士課程 真野 智之 (まの ともゆき)
群馬大学大学院 医学系研究科
教授 平井 宏和 (ひらい ひろかず)
講師 今野 歩 (こんの あゆむ)
研究支援
本研究の一部は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワーク全容解明プロジェクト」「ヒューマン・フロンティア・サイエンス・プログラム(HFSP)」、科学研究費補助金基盤研究B「血液脳関門透過AAVベクターを用いたレット症候群の遺伝子治療とMeCP2機能解析(研究代表者:平井宏和)」、基盤研究C「AAV中和抗体を回避する試み:脳内への遺伝子導入を繰り返し可能にする技術の開発(研究代表者:今野歩)」などの支援を受けて行われました。
背景
生物を構成する最小単位は細胞です。ヒトの体や臓器は、受精卵という一つの細胞から始まり、細胞分裂と分化を繰り返すことで形成されていきます。しかし、大量の細胞をただ混ぜ合わせるだけでは、ヒトの体や臓器はできず、全ての細胞が秩序立った空間的な相互作用をすることで、初めて機能が生み出されます。そのため、生命現象や病気の全容解明には、臓器に存在する全ての細胞一つ一つをカタログのように整理・解析する「全細胞解析」が不可欠です。
上田泰己チームリーダーらは、これまでにマウスや小型サルの脳における組織透明化技術「CUBIC」を開発し 注1) 、脳全体での薬理作用 注2) やがんの全身転移の可視化 注3) 、マウス全脳のアトラス作製 注4) 、さらには3次元のヒト臨床病理診断 注5) へ応用してきました。
全細胞解析には、①組織透明化試薬を用いた臓器の透明化処理と染色、②光シート顕微鏡による3次元撮影、③顕微鏡画像から細胞を検出・分類するデータ解析の三つのステップがあります。マウス全脳の場合、従来法では3次元撮影とデータ解析にそれぞれ24時間以上かかり、実用的な全細胞解析を実現するには、これらの高速化が必要でした。
注1) 2014年4月18日プレスリリース「成体の脳を透明化し1細胞解像度で観察する新技術を開発」
https://www.riken.jp/press/2014/20140418_1/
注2) 2016年3月18日東京大学プレスリリース「なぜ私たちは眠るか」
http://www.m.u-tokyo.ac.jp/news/admin/release_20160318.pdf
注3) 2017年7月6日東京大学プレスリリース「組織透明化による全身全細胞解析基盤の構築」
http://www.m.u-tokyo.ac.jp/news/admin/release_20170706.pdf
注4) 2018年3月8日プレスリリース「1細胞解像度を有する点描脳アトラスの創出」
https://www.riken.jp/press/2018/20180308_2/
注5) 2017年8月30日プレスリリース「組織透明化技術「CUBIC」をヒト病理組織診断に応用」
https://www.riken.jp/press/2017/20170830_1/index.html
研究手法と成果
共同研究グループは、透明サンプルの3次元撮影を高速化するために、「MOVIE-scan(高速撮影)」「MOVIE-skip(効率撮影)」「MOVIE-focus(リアルタイムオートフォーカス)」からなる高速イメージング技術「MOVIE」を開発しました。
3次元撮影の場合、高さ方向にサンプルを移動・停止させ撮影するという工程を繰り返します。一般的な方法では、撮影よりもサンプルの移動・停止に時間がかかることから、MOVIE-scanでは、サンプルを等速移動させながら撮影を行うことで、時間を短縮しました (図2a) 。
また、顕微鏡の視野よりも大きいサンプルは、複数のタイル領域に分割して撮影されます(タイリング撮影)。この撮影法では、撮影対象であるサンプルの外側の画像も取得してしまうことから、MOVIE-skipでは、次のタイルの初期位置にサンプルが戻る際に、サンプルの有無と存在場所を確認することで、サンプル外の空間を撮影する不用な時間を除きました (図2b) 。

図2 MOVIE-scan、MOVIE-skipにより高速化・効率化した撮影法
(a)従来の3次元撮影の場合、高さ方向にサンプルを移動・停止させ撮影するという工程を繰り返す。一般的に、サンプルの移動・停止には、5マイクロメートル(μm、1μmは1,000分の1mm)程度の細かな移動であっても150~200ミリ秒程度の時間がかかり、撮影時間よりも長い場合が多い。サンプルを等速移動させながら撮影を行うMOVIE-scanでは、この移動・停止にかかる時間を省けるため、高速撮影が可能である。
(b)顕微鏡の視野よりも大きいサンプルは、タイリング撮影といって、複数のタイル領域に分割されて撮影される。左上の従来法では、紫矢印のように指定した座標まで一律に撮影するため、サンプル外の何も写っていない画像も取得してしまう。左下のMOVIE-skipでは、点線の橙矢印のように、次のタイルの初期位置にサンプルが戻る際にサンプルの有無と存在場所(サンプル端)を検出しておくことで、紫の矢印のようにサンプルの端までを撮影することができる。これにより、右側で示すようにサンプル外の不用な領域の撮影を回避できる。
透明化された臓器には、内部構造の違いにより微妙な屈折率の違いがあります。そのため、高倍率の対物レンズで観察する場合、焦点がずれた画像にならないよう、対物レンズの焦点位置とレーザー光による光シートの焦点面を一致させる必要があります。従来法では、一定の間隔(高さ方向、0.5~1mm)ごとに、10~20枚の焦点の異なる画像を静止撮影して画像解析を行い、最も良い画像だった位置に焦点を調節し直すことで補正していました (図3左) 。このため、焦点を補正し直す直前は焦点のずれた画像になりやすく、高い品質で3次元撮影することが困難でした。
MOVIE-focusでは、光シート焦点面を毎回前後に微妙に振動させ、サンプルの移動に伴って生じた焦点位置が前後どちら側に変化したのかをリアルタイムで画像解析し、光シート位置の補正を行います。つまり、移動しながら常に焦点を合わせ続けるため、毎回明瞭な画像を得ることができ、従来法に比べて高速で常に高品質な3次元撮影が可能になりました (図3右) 。
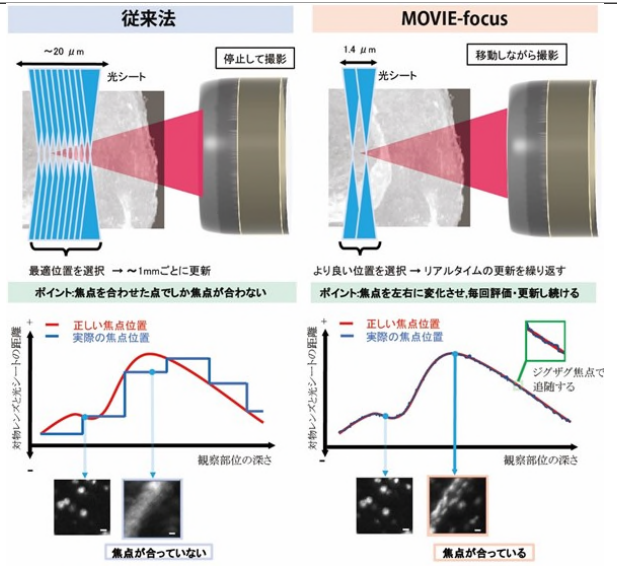
図3 リアルタイムで焦点を更新するMOVIE-focusによる撮影法
左:従来法では、高さ方向に一定の間隔で焦点の異なる複数の画像を取得し、最も焦点の合った位置に焦点を調節し直すことで、試料の高さごとの焦点の違いを補正していた。
右:MOVIE-focusでは光シート焦点面を毎回前後(図では左右)に微妙に振動させ、試料の移動に伴って生じた焦点位置が左右どちら側に変化したのかをリアルタイムで画像解析を行い、光シート位置の補正を行う。常に焦点を合わせ続けるため、明瞭な画像を毎回得ることができる。
次に、この高速イメージング技術「MOVIE」を用いて、高速・高解像の「光シート蛍光顕微鏡(MOVIE顕微鏡)」を作製しました (図4) 。観察用対物レンズの直後にダイクロイックミラー を置いたことで、異なる波長の蛍光シグナルを分離し、2台のカメラで同時に撮影できるため、細胞の位置情報(核画像)と細胞の状態情報(蛍光タンパク質、免疫染色画像など)の関係を正確に知ることができます。これらによって、従来では1秒間に4枚程度しか撮影できなかったものが、1秒間に20枚以上の画像を取得できるようになり、透明化されたマウス全脳の場合、従来の5分の1以下にあたる5~12時間で高解像に撮影できるようになりました。

図4 高速高解像度イメージングを可能にする「MOVIE顕微鏡」
(a)MOVIE顕微鏡。
(b)MOVIE顕微鏡の設計図。観察用対物レンズの直後にダイクロイックミラーを置くことで、異なる波長の蛍光シグナルを分離し、2台のカメラで同時に撮影できるようになっている。
また、CPUとGPUの並列計算に最適化したアルゴリズムを利用した3次元イメージの解析手法を開発し、データ解析に要する時間を8時間以内に短縮できました。
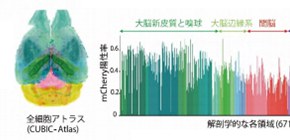
この解析法を膨潤透明化サンプル に適応したところ、マウス全脳の全細胞を2時間以内で検出できました (図5左) 。その結果、マウス全脳が約1億個の細胞で構成されていることが明らかになり、マウス全脳地図(アトラス)である「CUBIC-Atlas 」を更新しました。さらに、この最新データをもとに、遺伝子導入ツールとして用いられるアデノ随伴ウイルスベクター(AAV) の脳への感染効率を調べるため、感染した細胞が蛍光タンパク質を発現するようにしたAAVをマウスに投与してマウス全脳の解析を行いました。その結果、大脳新皮質や嗅球 周辺の細胞の多くが蛍光タンパク質を発現していることを突き止めました (図5右) 。

図5 CPU/GPU並列計算による高速細胞検出とCUBIC-Atlasを用いた解析
CPU/GPU並列計算に最適化した高速な3次元的な画像解析により、マウス全脳の3次元データ(2.5TB)から2時間以内に全細胞の自動検出ができる。これを、CUBIC-Atlasと位置を合わせることで、検出された全ての細胞がどの細胞なのか同定される。図では、アデノ随伴ウイルスベクターのAAV-PHP.eB:NSE-H2B-mCherryに感染して蛍光タンパク質(mCherry)を発現した細胞を、それぞれの解剖学的領域ごとに定量した結果を表している。大脳新皮質と嗅球の細胞の多くでmCherryが発現していた。
今後の期待
体を構成している細胞全てを対象として生命現象や病気の解明に取り組める全細胞解析は、高い精度の研究を可能とします。例えば、幹細胞など少数しかない細胞と病気の関係、がんなどさまざまな病態の解明につながります。
この高速な全細胞解析は、一般的に100以上に上るサンプルを利用する生物学・医学の基礎研究への応用、さらには創薬や臨床病理診断への応用にも寄与し、次世代の研究基盤になるものと期待できます。
論文情報
タイトル:Advanced CUBIC tissue clearing for whole-organ cell profiling
著者名:Katsuhiko Matsumoto, Tomoki T. Mitani, Shuhei A. Horiguchi, Junichi Kaneshiro, Tatsuya C.Murakami,Tomoyuki Mano,Hiroshi Fujishima,Ayumu Konno,Tomonobu M.Watanabe,Hirokazu Hirai, Hiroki R.Ueda
雑誌:Nature Protocols
DOI:10.1038/s41596-019-0240-9
参考URL
大阪大学 大学院医学系研究科 システム生物学
http://www.med.osaka-u.ac.jp/
用語説明
- CUBIC
@2014年に理化学研究所生命システム研究センターの上田泰己コア長(当時)らが開発した脳透明化試薬、3次元イメージングおよび画像解析手法の呼称。脳を脱脂した後、屈折率を均質化することで高い組織透明度を達成した。複数の脳サンプルを並行して透明化することが可能であること、および手法が簡便で再現性が良いことが特徴。CUBICはClear,Unobstructed Brain Imaging Cocktails and Computationalanalysisの略。
- MOVIE
本研究で開発した3次元サンプルを高速かつ高精度に撮影するための撮影手法。MOVIE-scan(高速撮影)、MOVIE-skip(効率的な撮影)、MOVIE-focus(リアルタイムオートフォーカス)からなる。MOVIEはMoving observation with efficient real-time auto focus の略。
- 光シート蛍光顕微鏡
レーザー光をシート状に広げてサンプルの横から照射し、上から撮影することで、サンプル内のある平面を撮影する顕微鏡のこと。サンプルをz方向(高さ方向)に動かすことで3次元画像を取得できる。
- GPU
画像処理を高速に行うためにコンピュータに装着される補助的な演算装置。近年、科学技術計算における一般的な演算を加速させることを目的としても広く用いられるGPUはGraphics Processing Unitの略。
- ダイクロイックミラー
特定の波長の光を透過させ、それ以外の波長の光を反射する鏡のこと。顕微鏡では、励起光と蛍光の分離や異なる波長のレーザーの融合などによく使用される。
- 膨潤透明化サンプル
全脳膨潤・透明化手法「CUBIC-X」により処理されたサンプル。組織透明化と同時に、組織自体を物理的に膨潤させることで、実質的に高解像な画像を得ることができる。
- CUBIC-Atlas
全細胞核を抽出し、それぞれの細胞が脳のどの領域に属するか注釈を与えることで構築された1細胞解像度のマウス脳アトラス。 CUBIC-Atlasサイト: http://cubic-atlas.riken.jp
- アデノ随伴ウイルスベクター(AAV)
病原性を持たない一本鎖DNAウイルス。特定の細胞や組織で目的タンパク質を発現させるための運び屋として利用される。近年では、マウスの血液脳関門を高効率に透過できる性質を持ち、静脈投与により脳全域に遺伝子導入が可能なAAV-PHP.eBが開発されており、本研究でも用いた。AAVはadeno-associated virus の略。
- 嗅球
嗅覚の1次中枢として機能する脳の領域。匂いを受容する嗅細胞(感覚神経細胞)の神経線維が直接接続している。
