遺伝子の入れ換えをコントロールするメカニズムを解明
ゲノム編集や不妊治療への応用に期待
研究成果のポイント
・ヒトにおいてDNA(遺伝子)の交換反応(相同組換え)が2種類のタンパク質・遺伝子によって厳密に制御されていることを発見
・DNAの径路選択や、組換えにブレーキをかける新規の抑制タンパク質
・遺伝子を発見・CRISPR/Cas9システムをはじめとしたゲノム編集技術や遺伝子組換え技術への応用、精子・卵形成における組換えをコントロールすることでヒトでの不妊治療や動植物での品種改良への応用に期待
概要
大阪大学蛋白質研究所の篠原彰教授、松嵜健一郎助教(当時。現近畿大学農学部助教)らの研究グループは、ヒト・マウスにおいてDNA交換反応の相同組換えがアクセル因子とブレーキ因子の相互作用と協調的な働きによって調節されていることを世界で初めて明らかにしました。
生体内でのDNA同士の交換反応である相同組換えは、DNAの傷を修復する重要な生体反応の1つです。細胞が増える時や子孫を残す時のゲノム情報の安定な継承に必須の役割を果たしています。適切ではない組換えが起きると、染色体上の遺伝情報の不安定化が起き、細胞のガン化につながります。遺伝性の乳がんの原因遺伝子BRCA1/2は組換えに関わることが知られています。このため、生体内で、組換えは適切にコントロールされる必要があります。これまではBRCA1/2に代表される、組換えを正に制御するアクセル役の因子についてはよく研究されてきましたが、ブレーキ役や、ブレーキ役とアクセル役の因子の協調的働きによる、組換えの制御の分子メカニズムについては解明されていませんでした。
今回、篠原教授、松嵜助教らの研究グループは、組換えのブレーキ役の新規タンパク質・遺伝子とこれを阻害するタンパク質・遺伝子を発見しました。2者のタンパク質の機能を明らかにすることで、生体内でのDNA同士の交換反応である相同組換えを適切に制御するメカニズムを解明しました。また、この仕組みがマウスでの精子・卵形成に必要不可欠であることも発見しました。今後、今回発見したタンパク質の機能を人工的にコントロール出来るようになれば、ゲノム編集による遺伝子改変や遺伝子組換え技術の最適化、組換えの欠損による不妊や発ガンの治療、あるいは効率的な育種の作成への応用が期待されます。
本研究成果は、英国科学誌「Nature Communications」に、3月29日(金)19時(日本時間)に公開されました。
研究の背景
DNAの似た配列同士を組換える相同組換えは、放射線などの環境的要因や精子・卵形成過程で引き起こされるDNAの切断を修復する機構です。相同組換えは、大腸菌からヒトまで保存されており、ヒトやマウスでは、生きる上で必要不可欠な機構であることが分かっています。相同組換えの機能欠損は、発ガン率との相関があることから、相同組換えはDNA切断を修復することで遺伝情報を正確に維持し、細胞のガン化を防いでいると考えられています。また、精子・卵形成の過程では父親から受け継いだ染色体と母親から受け継いだ染色体の間で組換えを行うことが精子や卵を作る際に必要不可欠であることも分かっています。相同組換えができない時に細胞のガン化が起きてしまう一方で、相同組換えが過剰に働いてしまう場合も染色体間で本来起こるべきではない組換えが多発してしまい、遺伝情報が正しく維持されず細胞のガン化を引き起こすと考えられています。このため、生体内で相同組換えは、必要な時に必要な場所で厳密に制御される必要があると考えられていますが、その具体的なメカニズムについては十分に解明されていませんでした。
本研究成果の内容
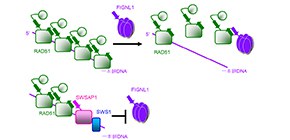
相同組換えの調節は、遺伝性の乳がんの原因因子BRCA2に代表される相同組換えを促進するRAD51メディエーター と呼ばれるタンパク質群と、相同組換えを抑制するアンチリコンビナーゼ と呼ばれるタンパク質群によって行なわれていると考えられています。今回、篠原教授、松嵜助教らの研究グループは、新規のアンチリコンビナーゼFIGNL1を発見しました。また、RAD51メディエーターの一つであるSWSAP1がアンチリコンビナーゼFIGNL1に直接結合し、阻害することで結果として相同組換えを促進しているというメカニズムを明らかにしました。さらに、SWSAP1のノックアウトマウスを作製し解析したところ、SWSAP1ノックアウトマウスの精巣、卵巣で精子形成、卵子形成が出来なくなっていることを発見しました。このことからSWSAP1とFIGNL1による相同組換えの調節が精子・卵形成に重要な役割を持つことを明らかにしました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、相同組換えの機能不全による発ガン率の上昇の原因解明や診断・治療方法の開発につながることが期待できます。また、今回発見した組換え因子を人工的に制御することで、不妊の治療、ゲノム編集の最適化など幅広い応用が可能であると考えられます。
特記事項
本研究成果は、2019年3月29日(金)19時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:“Human RAD51 paralogue, SWSAP1, fosters RAD51 filament by regulating the antirecombinase, FIGNL1 AAA+ ATPase”
著者名:Kenichiro Matsuzaki, Shizuka Kondo, Tatsuya Ishikawa, Akira Shinohara
なお、本研究は、日本学術振興会科学研究助成KAKENHI,22125001,22125002,15H05973 and 16H04742の支援を得て行われました。
参考URL
大阪大学 蛋白質研究所 ゲノム染色体機能研究室
http://www.protein.osaka-u.ac.jp/genome/
用語説明
- RAD51メディエーター
RAD51 mediator:
相同組換えを促進するタンパク質群。相同組換えを行うRAD51タンパク質をDNA上に乗せる、もしくは安定化することによって組換えを促進している。遺伝性の乳がんの原因因子BRCA2はその代表例である。また、RAD51C,Dもこのグループに属するが、卵巣がんのリスク因子であることもしられている。
- アンチリコンビナーゼ
anti-recombinase:
相同組換えを抑制するタンパク質群。相同組換えを行うRAD51タンパク質をDNA上から外す、もしくは組換え中間体を壊すことで組換えを抑制している。
