B細胞の暴走を防ぐスイッチを発見
Tet 分子が自己免疫疾患を抑制する
研究成果のポイント
・B細胞に発現するエピゲノム制御因子 Tetの機能欠損により、全身性エリテマトーデス 様の自己免疫疾患が引き起こされる。
・Tet分子が、自分の体を攻撃するB細胞に不活性化を引き起こすことで、自己免疫疾患を抑制する。
・Tet分子、もしくはその関連分子の機能制御によって、自己免疫疾患を抑制する画期的な治療薬開発が期待される。
概要
大阪大学免疫学フロンティア研究センター分化制御研究室の伊勢渉特任准教授(常勤)、黒﨑知博特任教授(常勤)(理化学研究所生命医科学研究センター兼任)、九州大学生体防御医学研究所免疫ゲノム生物学分野の田中伸弥准教授、馬場義裕教授らの研究グループは、エピゲノム制御因子Tetが、B細胞が有する"自己の組織に対する攻撃性"を抑えることにより、自己免疫疾患の発症を抑制していることを世界で初めて明らかにしました。
B細胞、T細胞といったリンパ球は、通常、細菌、ウィルスなどの微生物感染において、生体防御反応の中心的役割を担います。一方、生体内には、自己の組織に攻撃性をもつリンパ球(自己反応性リンパ球)が存在することがわかっていますが、通常は、不活化されています。しかし、何らかの原因で活性化した場合、この異常活性化によって引き起こされる自己反応性B細胞-T細胞間の相互作用によって、自己免疫疾患が引き起こされることが知られています。これまで、どのようにして攻撃性が抑制されているのか不明でしたが、本研究グループは、Tet分子が、B細胞において、T細胞との相互作用を促進する分子の過剰発現を阻止することで、攻撃性を抑制し、自己免疫疾患の発症を防いでいることを解明しました (図1) 。
マウス生体内において、Tet分子をB細胞でのみ欠損させることで、異常に活性化したB細胞が、脾臓等のリンパ組織に蓄積し、B-T細胞相互活性化を促すCD86分子 を過剰に発現することを見出しました。さらに、このCD86分子機能を阻害することにより、これらリンパ球の異常活性化を抑制するばかりでなく、自己免疫疾患病態が改善することを証明しました。さらに、CD86分子の過剰発現は、Tet分子欠損よって引き起こされるエピゲノム転写抑制の破綻によって、起きうることを突き詰めました。今後、Tet分子または、その関連分子を標的とした新たな治療薬開発が期待されます。
本研究成果は、科学誌「Nature Immunology」に、6月23日(火)午前0時(日本時間)に公開されました。
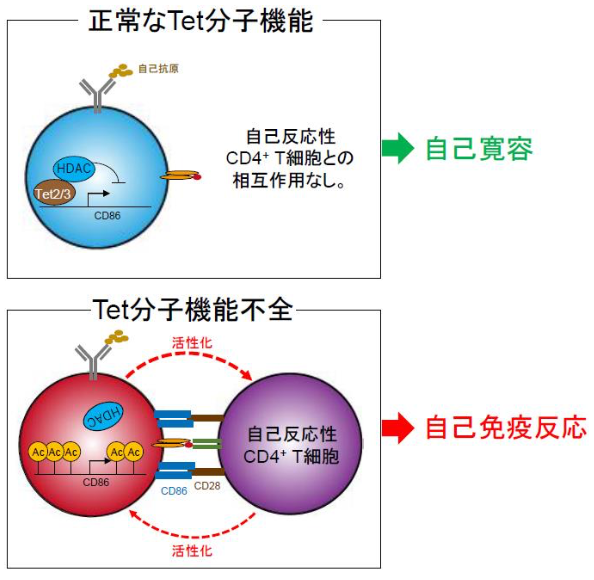
図1 Tet分子による自己寛容制御
Tet分子の機能不全によって、自己抗原を認識したB細胞は、CD86分子を過剰発現し、自己反応性T細胞を活性化することで自己免疫応答を引き起こす。
研究の背景
B細胞、T細胞といったリンパ球は、微生物に対する生体防御反応において中心的な役割を果たしますが、一部のリンパ球は、自己の組織に対する攻撃性(自己反応性)を有しており、自己免疫疾患を引き起こす潜在的リスクとなっています。通常、これらのリンパ球は、自己寛容と呼ばれるメカニズムによって、不活化されていますが、何らかの原因で自己寛容が破綻した場合には、自己反応性リンパ球同士の相互作用により、自己免疫疾患の発症に至ります。しかしながら、どのような分子メカニズムによって、自己寛容が誘導、維持されているかについては、十分に明らかではありませんでした。
本研究の成果
本研究グループでは、エピゲノム制御因子Tet(Tet2, Tet3)をB細胞で特異的に欠損するノックアウトマウスを樹立することにより、リンパ組織における自己反応性B細胞の活性化、蓄積のみならず、T細胞の恒常的活性化が起こることを見出しました。また、これらノックアウトマウスにおいては、自己抗体産生、腎臓における抗体沈着、非リンパ組織における細胞浸潤を伴った全身性エリテマトーデス様の自己免疫疾患が発症することが明らかになりました(図2)。これらの病態形成には、B細胞-T細胞間の相互作用が原因となることを明らかにしました。また、網羅的な遺伝子発現解析を用いることでTet分子欠損によって、これら細胞相互作用を促す共刺激分子CD86の発現が亢進していることが示され、自己免疫疾患発症前にCD86に対する中和抗体を投与することで、恒常的リンパ球活性化のみならず、疾患病態をも抑制されることが証明されました。よって、Tet分子欠損によるCD86過剰発現が、自己寛容の破綻ならびに、自己免疫疾患を引き起こす1つの鍵であることが示されました。
さらに、全ゲノムレベルでヒストン脱アセチル化酵素HDAC 結合、及び、アセチル化ヒストン の分布を調べることで、Tet分子欠損によって、CD86遺伝子座にHDACの集積が減少し、それに対応して、アセチル化ヒストンの過剰集積が認められました (図3) 。よって、Tet分子が、CD86遺伝子座に転写抑制構造を形成することで、CD86過剰発現を阻止し、過剰なB-T細胞相互作用を阻害することによって、自己寛容の誘導、維持を担うことが考えられました。
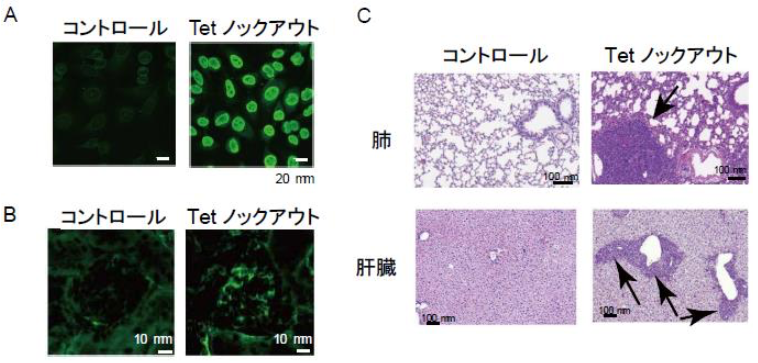
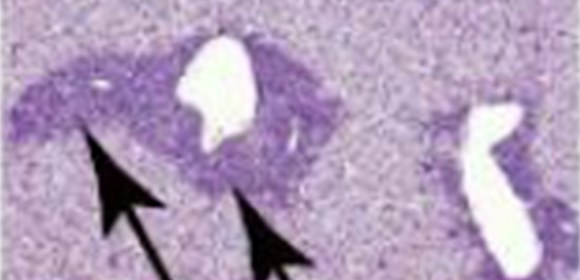
図2 Tet分子欠損による全身性エリテマトーデス様疾患
A. 血清中の核抗体産生
B. 腎臓の抗体沈着
C. 肺、肝臓における細胞浸潤
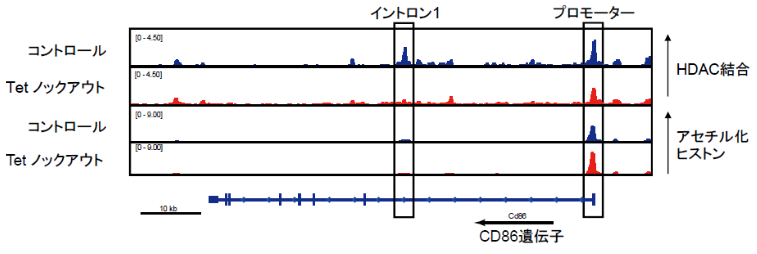
図3 CD86遺伝子座におけるHDAC結合、アセチル化ヒストン分布Tet分子欠損によって、CD86遺伝子座におけるHDAC結合が減少し、ヒストンアセチル化修飾が上昇した。
本研究成果が社会に与える影響(本研究成果の意義)
自己免疫疾患は、全人口の数%が罹患する難治性疾患の一つです。これら疾患群においては、全身または、臓器特異的に起こる慢性炎症が、長期にわたって、身体機能の低下を引き起こすことで、生活の質の悪化を招きます。自己免疫疾患は様々存在しますが、共通の発症メカニズムは、リンパ球における自己寛容の破綻と考えられています。本研究によって、自己寛容を誘導、維持を担う基盤分子メカニズムが解き明かされたことで、そのメカニズムを標的とする新たな治療の開発が期待されます。
特記事項
【掲載誌】Nature Immunology(オンライン) 2020年6月23日(日本時間)に掲載
【タイトル】"Tet2 and Tet3 in B cells are required to suppress CD86 and prevent autoimmunity"
【著者名】 Shinya Tanaka 1, 2, 11 , Wataru Ise 1 , Takeshi Inoue 1 , Ayako Ito 1 , Chisato Ono 2 , Yoshihito Shima 3 , Shuhei Sakakibara 4 , Manabu Nakayama 5 , Kentaro Fujii 1 , Ikuo Miura 6 , Jafar Sharif 7 , Haruhiko Koseki 7, 8 , Pandelakis Koni 9 , Indu Raman 10 , Quan-Zhen Li 10 , Masato Kubo 11 , Katsunori Fujiki 12 , Ryuichiro Nakato 12 , Katsuhiko Shirahige 12 , Hiromitsu Araki 13 , Fumihito Miura 13 , Takashi Ito 13 , Eiryo Kawakami 14, 15 , Yoshihiro Baba 1, 2 , and Tomohiro Kurosaki 1, 16
【所属】
1 大阪大学 免疫学フロンティア研究センター 分化制御研究室
2 九州大学 生体防御医学研究所 免疫ゲノム生物学分野
3 大阪大学 大学院医学系研究科 血管作動温熱治療学共同研究講座
4 大阪大学 免疫学フロンティア研究センター 免疫機能統御学
5 公益財団法人かずさ DNA研究所 先端研究開発部 オミックス医科学研究室
6 理化学研究所 バイオリソース研究センター マウス表現型解析開発チーム
7 理化学研究所 生命医科学研究センター 免疫器官形成研究チーム
8 千葉大学 大学院医学研究院 先端研究部門
9 オーガスタ大学 ジョージアがんセンター
10 テキサス州立大学 サウスウェスタンメディカルセンター
11 東京理科大学 生命医科学研究所
12 東京大学 定量生命科学研究所 先端定量生命科学研究部門
13 九州大学 大学院医学研究院 医化学分野
14 理化学研究所 医科学イノベーションハブ推進プログラム
15 千葉大学 大学院医学研究院 人工知能(AI)医学
16 理化学研究所 生命医科学研究センター 分化制御研究チーム
参考URL
免疫学フロンティア研究センター分化制御研究室HP
http://lymph.ifrec.osaka-u.ac.jp/index.html
用語説明
- エピゲノム制御因子
DNA配列変化を伴わない遺伝子発現制御(エピゲノム制御)を仲介する分子。クロマチン構造変化などを引き起こすことによって、遺伝子発現調節に関わる。
- 全身性エリテマトーデス
(systemic lupus erythematosus; SLE)/全身のさまざまな臓器に多彩な症状を引き起こす免疫疾患(指定難病49)。特に腎障害を伴う。全国に10万人程度の患者がいると思われる。
- CD86分子
B細胞、樹状細胞等の抗原提示細胞に発現し、T細胞の活性化を促す細胞表面分子。
- HDAC
(Histone deacethylase)/ヒストンの脱アセチル化を行う酵素。一般的に遺伝子発現の不活性化に寄与する。
- アセチル化ヒストン
アセチル基が付加されたヒストン。一般的にヒストン分子のアセチル化は、遺伝子発現の活性化と相関する。

