組織常在マクロファージはメタボをメンテナンスしていた!
マクロファージ概念 攻撃型からメンテナンス型へのパラダイムシフト
リリース概要
最近、アレルギーや癌といった様々な疾患にM2マクロファージという細胞集団が関与していると報告され始めています。大阪大学免疫学フロンティア研究センターの佐藤荘助教と審良静男教授らの研究グループは、このM2マクロファージの中でも体内の様々な末梢組織に存在しているM2マクロファージを組織常在型M2様マクロファージと命名し、この細胞の分化を司る遺伝子としてTribble1(Trib1) を発見しました。 更に、Trib1遺伝子欠損マウスでは、リポディストロフィー及びそれに起因して発症するメタボリックシンドロームの病態を呈する事を世界で初めて証明しました。
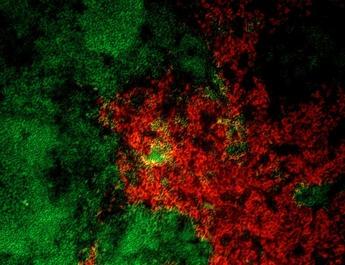
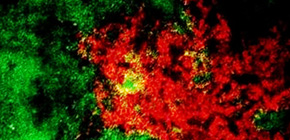
図 脾臓中でのB細胞(緑)と組織常在型M2様マクロファージ(赤)
研究の背景
癌、アレルギー、メタボリックシンドロームから組織の再生に至るまで、人類が直面している病態に深く関与していると考えられている細胞が、「M2マクロファージ」と呼ばれる特殊な細胞集団です。これまでの我々の研究において、アレルギー物質によって誘導される誘導型M2マクロファージについては研究されていましたが、もともと組織に常在している組織常在型M2マクロファージについては発生の仕方や、その生体内での機能が不明でした。
本研究成果が社会に与える影響(本研究成果の意義)
本研究グループはマクロファージの分化や活性化に関与する遺伝子の発現パターンを網羅的に解析し、Trib1という遺伝子に着目しました。Trib1遺伝子欠損マウスでは、末梢組織中の組織常在型M2様マクロファージが著明に無くなっており、更には、このマウスは脂肪組織が縮小してしまうリポディストロフィーという病態を発症していました。高カロリーの食事をこれらのマウスに与えたところ、野生型よりも病状が進行したメタボリックシンドロームを呈しました。以上から、本来マクロファージとは、病原体を排除するという攻撃的な性格を持っていると考えられていましたが、本研究によってこの組織常在型M2様マクロファージは、脂肪細胞の様な末梢組織のメンテナンスを行っている事が明らかとなりました。今回発見した研究成果は、リポディストロフィーやこれによって引き起こされるメタボリックシンドロームの様な病態の改善につながる薬の開発を行う上で極めて重要な研究成果であると考えられます。さらに、他にも存在している様々なM2マクロファージの研究が、癌や動脈硬化の様な世界中で多くの人を苦しめる疾患の治療法の開発にもつながる可能性が強く示唆されます。
特記事項
本成果は、2013年3月20日の午後6時(ロンドン)に雑誌「Nature」オンライン版に掲載されます。
本研究は、内閣府/日本学術振興会・最先端研究開発支援プログラムの支援を受けて行われました。
研究の詳細
研究の背景
自然免疫において中心的な役割を果たしているマクロファージは、細菌やウイルス感染の際に活性化し、それらを排除する。また、寄生虫感染、アレルギー応答、脂肪代謝、創傷治癒及び癌の転移・浸潤等にも寄与している可能性が近年の研究から明らかとなりつつある。これらの病態はそれぞれ異なったマクロファージによって担われていると考えられており、前者の病原体の感染の際に活性化する細胞集団をM1マクロファージ、一方で、後者の病気の際に活性化する細胞集団をM2マクロファージと呼称している。しかしながら、今までの研究ではマクロファージの実際にどのように生体内で働いているのか、そしてどのようにそれらの細胞は生まれてきているのかについては殆ど分かっていなかったので、我々はM2マクロファージが生まれてくるメカニズムや、生体内での役割に焦点を当てて研究を行った。
以前に我々は世界に先駆けて、エピジェネティックな遺伝子発現制御因子Jmjd3がアレルギー応答や寄生虫感染の際に活性化するM2マクロファージの分化を司っていることを報告した (Satoh T et al., Nature immunology, 2010)。 最近の研究結果から、我々哺乳類の体内には様々な種類のM2マクロファージが存在していることが報告されてきている。そこで生体内に存在している全てのM2マクロファージがJmjd3によって制御を受けているかどうかを調べる為に、M2型のマクロファージの一つとして報告されている“組織常在型マクロファージ”について、Jmjd3遺伝子欠損マウスを用いて解析を行った( 図1 )。 その結果、Jmjd3が欠損している状況下においても脾臓や肝臓、脂肪組織等の組織常在型マクロファージは正常に存在し、さらにその遺伝子発現も野生型と比較して同等であったことから、組織常在型マクロファージはJmjd3非依存的な分化の経路を辿っている可能性が考えられた。
組織常在型マクロファージ
我々はマクロファージを用いた様々なDNA microarrayのデータを網羅的に解析し、その結果Tribble1 (Trib1) に着目した。このTrib1はTrib2及びTrib3と共にTribbleファミリーを形成しており、これらの遺伝子は様々な生物種を超えて広く保存されている。更には、Trib1とTrib2とは血液の癌である白血病との関連も示唆されている。しかしながら、Trib1と免疫系細胞の分化との関係性については解明されていなかった。 そこで、我々は作成したTribbleファミリーの遺伝子欠損マウス (Trib1 -/- 、Trib2 -/- 及びTrib3 -/- マウス)を用いて、これらの遺伝子の生体での機能解析を行った。その結果、Trib1 -/- マウスにおいてのみ、組織常在型マクロファージが著明に減弱していることが明らかとなった ( 図2 )。この他、このTrib1 -/- マウスでは好酸球が減少しており、好中球はわずかに増加している事も確認された。
これらのマクロファージは遺伝子発現を調べてみると、Arg1やFizz1の様なM2マクロファージが発現している遺伝子を強く発現しているが、Jmjd3によって分化するタイプのM2マクロファージとは異なる物であったため、我々はこれらのマクロファージを組織常在型M2様マクロファージ (tissue-resident M2-like macrophage) と命名した。
組織常在型M2様マクロファージの分化メカニズム
免疫系に関与している細胞の分化は、その殆どの場合が骨髄で始まり、それらが血流にのって末梢の組織に移行する。末梢の様々な組織で確認された結果と同じように、Trib1 -/- の骨髄でもマクロファージの割合は著明に減弱していた。次に、野生型及びTrib1 -/- 骨髄細胞を回収し、放射線照射したマウスに骨髄移植した場合においても同様の結果が得られたことから、Trib1は骨髄細胞側で作用する事により、マクロファージ等の細胞の分化に影響を与えていることが明らかとなった。それでは、どの様な分子メカニズムによってTrib1が周りの蛋白質に作用しているかを明らかにするために、野生型とTrib1 -/- 骨髄細胞とを用いてコロニーアッセイを行った。最近、ES細胞やiPS細胞由来の造血幹細胞の分化能を調べるシステムとしてコロニーアッセイと言うシステムが頻繁に用いられる。コロニーアッセイでは、細胞表面マーカー、遺伝子発現解析では得られない分化能を示すコロニー数やコロニーの種類についての解析結果を得られることができる。末梢器官における結果と一致して、Trib1 -/- 骨髄からは正常なマクロファージコロニーや好酸球コロニーの出現は殆ど確認できなかった。Trib1はそのC末端にタンパク質分解に関与するE3ユビキチンリガーゼであるCOP1との結合部位を所持している。そこで、Trib1を欠損させた骨髄細胞に、野生型のTrib1とCOP1結合部位を削った変異型Trib1とを各々再発現させ、それらの細胞を用いて再度コロニーアッセイを行ったところ、前者の野生型を発現させた細胞ではマクロファージコロニー等が再発現したが、後者の変異型を発現させた細胞では同コロニーの再発現は観察できなかった( 図3 )。以上の結果からTrib1-COP1複合体は未知の目的遺伝子の発現量を調節することによって、これらの分化に寄与していることが明らかとなった。そこでこの複合体のターゲットとなっている遺伝子を同定するために、分化に重要であることが報告されている転写因子の発現量を野生型とTrib1 -/- 細胞とで網羅的に比較して調べた。その結果、転写因子C/EBPαの発現量がTrib1 -/- 細胞で上昇していることが分かったので、RNAiの技術を応用してTrib1 -/- 骨髄細胞においてC/EBPαの発現量を低下させた細胞を用いて再度コロニーアッセイを行ったところ、正常なマクロファージコロニーの再形成が観察された。
以上の結果から、Trib1はC/EBPαの発現量をCOP1依存的に調節することによって、マクロファージの分化を司っていることが明らかとなった。
リポディストロフィーとM2様マクロファージ
全ゲノム相関解析の結果から、遺伝的にTrib1に変異を所持する患者は脂質代謝に異常をきたすことが報告されている。これらの研究結果から、私達は続いてTrib1 -/- の脂肪組織を調べた。脂肪組織でも組織常在型M2様マクロファージはTrib1 -/- マウスでは著明に減弱していた。さらに興味深い事にMRIを用いた解析から、このTrib1 -/- マウスでは脂肪組織が萎縮するリポディストロフィーの症状を呈していることが明らかとなった( 図4 )。この病態はM2様マクロファージをこの遺伝子欠損マウスに移植することにより改善したことから、リポディストロフィーはM2様マクロファージの欠損から生じること、即ち、この組織常在型M2様マクロファージが脂肪細胞のメンテナンスを行っている事が明らかとなった。
メタボリックシンドロームとM2様マクロファージ
リポディストロフィーの発症はしばしば重篤なメタボリック症候群を発症させる。通常の食事下に於いてはコレステロールやトリグリセリドの血中濃度はTrib1 -/- マウスでは野生型と同程度の物であったが、高脂肪食をこれらのマウスに与えた時には、これらの値はTrib1 -/- マウスにおいて野生型と比較して著しく上昇したほか、耐糖能異常やインスリン抵抗性といった糖尿病患者が示す病状を呈した( 図5 )。またTrib1 -/- マウスの脂肪組織では炎症性サイトカインであるTNFαの発現が著しく上昇していた。以上の結果から高脂肪食下に於いて、Trib1 -/- マウスでは、リポディストロフィーを起因とした重度のメタボリックシンドロームの病態を発症していることが明らかとなった。
まとめと今後の展開
本来、マクロファージとは生体内に侵入してきた病原性のバクテリアやウイルスを排除するという攻撃的な性格を持っている細胞集団と考えられていたが、それとは対照的に、この組織常在型M2様マクロファージは脂肪細胞といった末梢組織のメンテナンスを行っている事が明らかとなった。以前に私達は、エピジェネティックな遺伝子制御を行うJmjd3の働きによって分化してくるM2マクロファージが、アレルギー反応と深く関与していることを報告した。しかしながら、このタイプのM2マクロファージは脂肪組織等のメンテナンスには関与していないことが本研究により明らかとなった。さらに興味深い事に、Trib1によって分化してくるM2様マクロファージは、アレルゲンに対して正常に応答した。以上の研究結果から考察すると、我々の体内には様々なタイプのM2マクロファージが存在していることが予想される。
またヒトにおける全ゲノム相関解析から、Trib1に点変異を所持している場合において、代謝疾患を引き起こす可能性があると報告されている。したがって、今回のマウスでのTrib1の作用機序と非常に類似した方法でヒトでも機能していることが推測されることから、この遺伝子の発現の調節が代謝疾患を克服するための創薬の新たな切り口となる事が考えられる。また、癌の転移や浸潤、動脈硬化等、現代の多くの人が直面している疾患に、このM2マクロファージの関与が示唆されていることから、各々の疾患に関与するM2マクロファージの分化や活性化、そしてどのようにその疾患にこの細胞が影響を与えているかという作用機序を調べることにより、これらの病態の克服に向けての大いなる一歩を踏み出すことが可能となる。
発表論文
"Critical role of Trib1 in differentiation of tissue-resident M2-like macrophages"
(組織常在マクロファージ分化におけるTrib1の決定的な役割)
雑誌:Nature
参考図
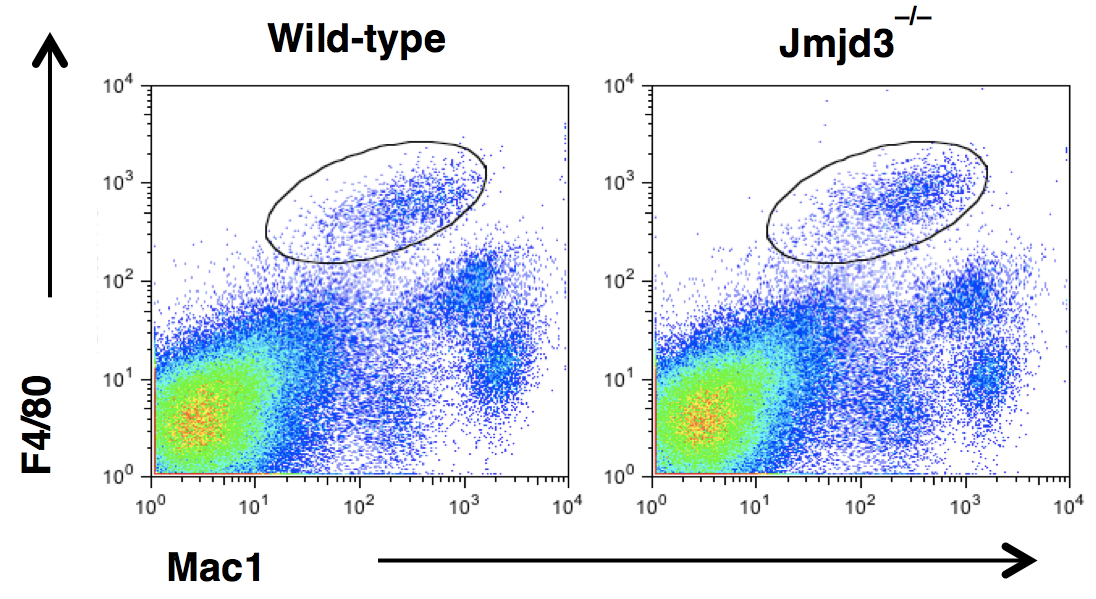
図1 Jmjd3 -/- マウスにおける組織常在型マクロファージ
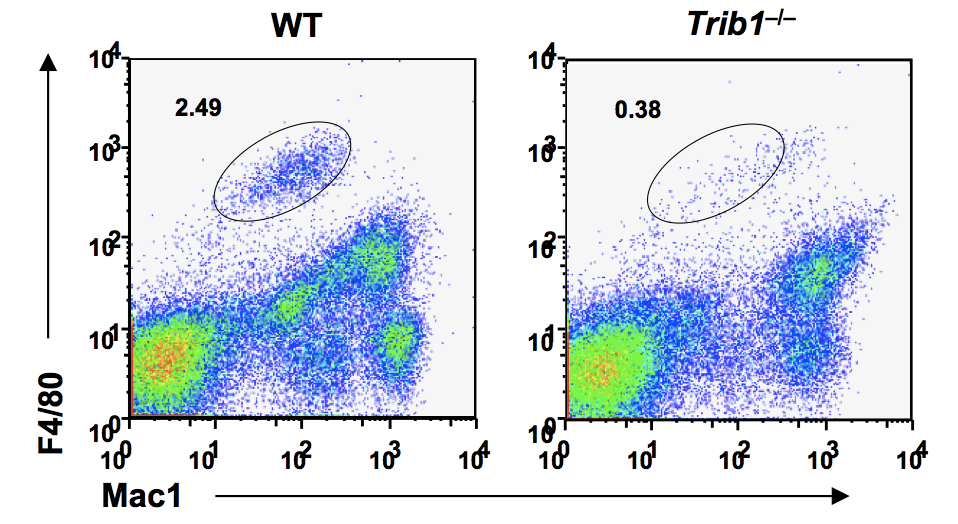
図2 Trib1 -/- マウスにおける組織常在型マクロファージ
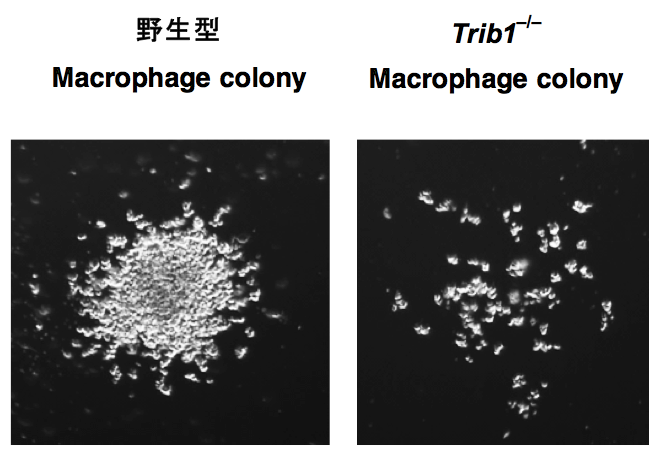
図3 コロニーアッセイにおける マクロファージコロニー
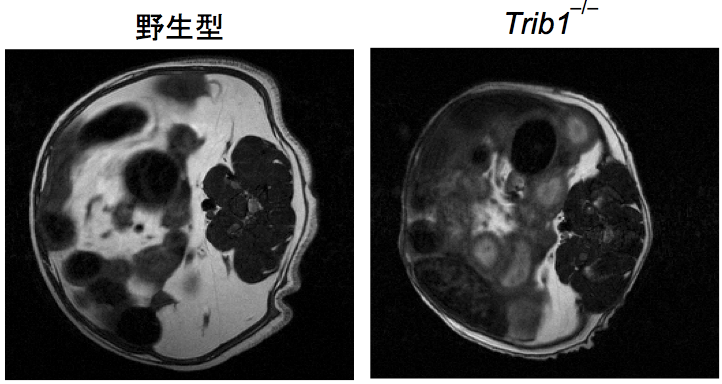
図4 野生型及びTrib1 -/- マウスのMRI画像
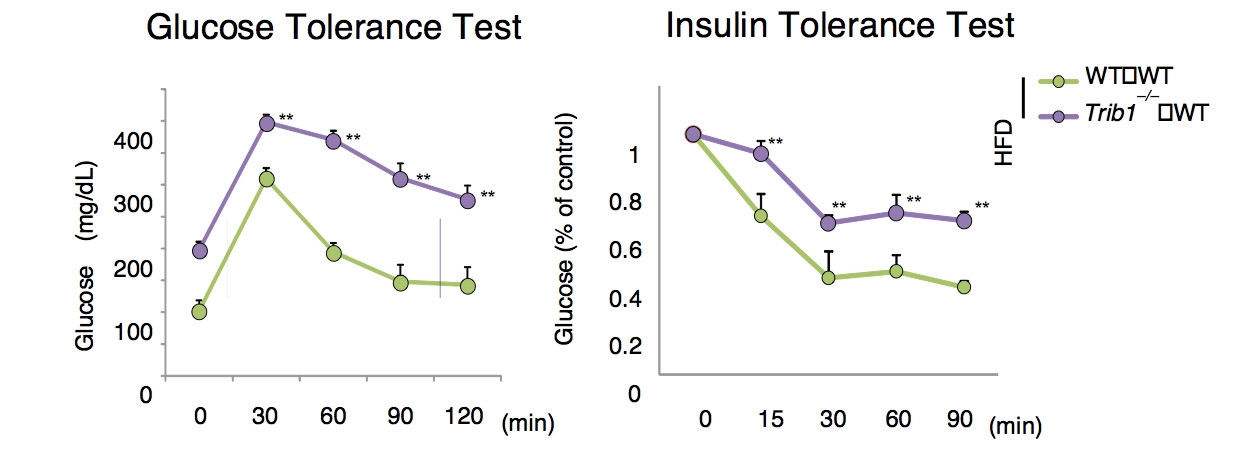
図5 高脂肪食下における、マウスの耐糖能試験及びインスリン抵抗性試験
