有効な治療薬のない難病線維症の発症原理を解明
関連遺伝子Rbm7の発見
研究成果のポイント
・マウスモデルの実験から免疫細胞と非免疫細胞の相互作用が線維症 発症の鍵であることを発見。
・上記の非免疫細胞で細胞死が起こる際に、RBM7という遺伝子(タンパク質)が特異的に誘導され、細胞死の誘導を起こすことを世界で初めて明らかにした。
・ヒトの臨床検体においてもRBM7は線維症の発症に伴って発現が著しく上昇することを発見した。現在、線維症に有効な薬は1剤も無いが、今後、RBM7を標的とすることにより肺・肝臓などの線維症を抑制する薬の開発が可能に。
概要
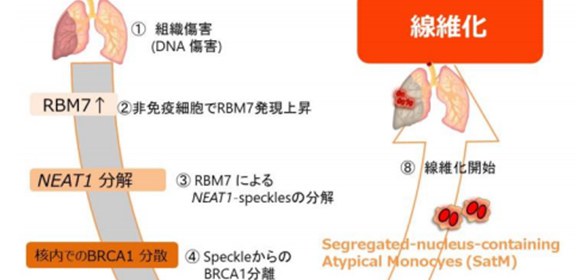
大阪大学大学院医学系研究科の福島清春招へい教員、免疫学フロンティア研究センターの佐藤荘准教授、審良静男特任教授(常勤)らの研究グループは、新しい線維症関連遺伝子RBM7を発見し、この遺伝子による線維症発症メカニズムの一端を解明しました (図1) 。
同グループは、マウスモデルを用いた実験によって、線維化の発症時には非免疫系細胞の細胞死が起こり始めること、その死にゆく細胞からケモカイン の一種CXCL12が発現され、線維化の起点となるマクロファージであるSegregated nucleus containing atypical monocyte(SatM)が患部に集積することを明らかにしました。
上記の非免疫細胞で細胞死が起こる際に、RBM7という遺伝子が特異的に誘導される事を発見しました。この分子がNEAT1というnon-coding RNAを分解し、その結果、NEAT1が形成する核内構造体(NEAT1-speckle)中に局在するBRCA1(DNAに入ったダメージを修復するタンパク質)の核内分布に変化が起こり、その結果、細胞死の誘導が起こることを世界で初めて明らかにしました。現在、線維症に有効な薬は1剤も無い状況ですが、RBM7を標的とした研究を行う事により、これまで有効な治療法のなかった線維症に対する創薬を開始することが可能となります。
本研究成果は、米国の科学雑誌『Immunity』(日本時間3月18日午前1時)にオンライン掲載されました。
図1 RBM7による線維化制御メカニズム
研究の背景
線維症は現在も多くの患者の命を奪う非常に重篤な疾患ですが、発症に関わる詳細なメカニズムは不明でした。線維症の発症には免疫細胞が関与していると考えられてはいましたが、どの免疫細胞が線維化の発症に関わるかは不明でした。審良教授らの研究グループでは線維化の進行とともに患部に集まる単球が線維症の発症に関与していることを解明し、これまでに報告のない新しい細胞であったために、SatMと名前を付けて報告しました(Satoh T et al . Nature 2017)。そして、次に解き明かす命題として、SatMの線維化部位への遊走メカニズムおよび線維化の開始時期に各臓器でおこる現象・変化を解き明かすことが重要であると考えました。
本研究の成果
審良教授、佐藤准教授らの研究グループでは、マウスのブレオマイシン肺線維症モデルにおいて線維化期の肺から分泌されるケモカインであるCXCL12がSatMの遊走に重要な役割を果たしていることを見いだしました。加えて、このCXCL12は非免疫細胞、特に傷害を受けた上皮で細胞死に伴い高度に誘導されることを見出しました。これにより、非免疫系(免疫系の周辺環境)の研究が線維症のメカニズムの解明のために重要であると考え、非免疫細胞において網羅的な遺伝子発現解析を施行し、線維化の発症に伴って高度に発現が上昇する遺伝子(タンパク質)としてRBM7を見出しました。RBM7はRNAを認識して、その分解に関わることはわかっていますが、生体における役割は殆どわかっていませんでした。RBM7の生体内での機能解析を行うために、ノックアウトマウス(Rbm7 )を作製し、解析を行いました。すると、驚くべきことにRbm7 マウスは患部へのSatMの集積が起こらず、線維症に強く抑制されていることを見出しました。さらに、RBM7は線維化期の肺上皮で上昇し,この時期に起こる持続的な肺上皮細胞死の原因となっていることを明らかにしました。RBM7が線維化に伴って起こる細胞死に関わる分子メカニズムを解明するため、本分子と結合するRNAを同定するRNA免疫沈降実験及びRBM7の有無により発現が変動する遺伝子を検索するRNA-seq解析 ※3 を行った結果、NEAT1というlong non-coding RNA ※4 の分解に関わることが明らかになりました。さらに、そのNEAT1が形成する核内構造体(NEAT1-speckle)の中には、DNAに入ったダメージを修復する機能を持つタンパクであるBRCA1が局在している事を突き止め、Rbm7欠損下ではBRCA1の核内分布が変化することにより、細胞死の誘導が起こることを明らかにしました。RBM7は肝臓・腎臓においても線維化に伴い顕著に発現が上昇し、Rbm7 -/- マウスは肝臓・腎臓の線維化も著しく抑制しました。
以上より、RBM7によって制御された細胞死が線維化進展において各種の臓器で重要な役割を果たしていることが明らかとなりました。
また非常に重要なことに、RBM7はヒトにおける肺線維症・肝硬変・腎硬化症などの線維化を伴う病態において、疾患の発症に伴って発現が高度に上昇していることも本研究によりわかりました。
本研究成果の意義
肺線維症は診断後3~5年で約半数が死亡する非常に重篤な疾患です。腎線維症や肝臓の線維症である肝硬変も同様に、有効な治療法が未だ存在していないために不治の病とされています。これまで病態解析について数多くの研究がなされ、各種の知見が蓄積されているものの、未だ線維症の発症メカニズムは不明な点が多く残されていました。
今回、研究チームは、線維化期に特異的に誘導されるRBM7という遺伝子が線維症の発症に関与していることを解明しました。そして、線維化が始まってからであっても、核酸を用いてRBM7の発現を抑制すると、その時点から病態の進行が抑制されることも明らかにしました。RBM7はヒト線維症患者においても発現が上昇していることから、本研究で得られた知見を利用して、RBM7を標的とした治療法が開発されれば、これまで有効な薬のなかった線維症に対して高い効果を示す薬が得られることが期待されます。既に、製薬企業と本分子を標的とした創薬活動が開始されています。
特記事項
本研究成果は、2020年3月18日(水)午前1時(日本時間)に米国科学誌『Immunity』(オンライン)に掲載されました。
【タイトル】”Dysregulated expression of the nuclear exosome targeting complex component RBM7 in non-hematopoietic cells licenses the development of fibrosis”
【著者】Kiyoharu Fukushima, Takashi Satoh, Fuminori Sugihara, Yuki Sato, Toru Okamoto, Yuichi Mitsui, Sachiyo Yoshio, Songling Li, Satoshi Nojima, Daisuke Motooka, Shota Nakamura, Hiroshi Kida, Daron M. Standley, Eiichi Morii, Tatsuya Kanto, Motoko Yanagita, Yoshiharu Matsuura, Takashi Nagasawa, Atsushi Kumanogoh, and Shizuo Akira
参考URL
大阪大学免疫学フロンティア研究センター 自然免疫学研究室HP
http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
用語説明
- 線維症
肺、肝臓等、生命活動に重要な臓器が一旦ダメージを受け、修復の過程で誤ってI型コラーゲンなどの膠原繊維が集積した場合に、臓器が弾性を失って硬化し正常な役割が出来なくなる疾患。肺、心臓、肝臓、腎臓、皮膚等々、重要な臓器で起こりうる疾患。現在、この病気に対する根本的な治療薬は開発されていない。
- ケモカイン
白血球やリンパ球などの細胞を組織へ遊走させるのに必要な物質の総称。
- RNA-seq解析
細胞に含まれるメッセンジャーRNAからcDNAを作成し、増幅した後に次世代シークエンサーを用いて読み取ることで、全遺伝子の発現量を細胞毎に定量解析する手法。
- long non-coding RNA
ノンコーディングRNA(non-coding RNA、ncRNA、非コードRNA)はタンパク質へ翻訳されずに機能するRNAの総称であり、非翻訳性RNA(non-translatable RNA)ともいう。この中で、200塩基以上のRNAを長鎖ノンコーディングRNA(long non-coding RNA:lncRNA)と呼び、ヒトでは,タンパク質コード遺伝子より遥かに多い種類のlncRNA遺伝子と転写産物が存在することが明らかになっているが、そのほとんどの機能は未だ不明である。
