痛風の炎症を抑えるメカニズムを解明!
微小管を介した自然免疫の活性化が生活習慣病を引き起こす
リリース概要
栄養素の過剰摂取が引き金となり発症する生活習慣病は、現代社会における重要な健康問題となっています。近年の研究により、生活習慣病の発症には自然免疫機構を介した炎症の誘導が深く関わることが明らかになってきました。自然免疫機構は、病原性微生物を排除するための感染防御機構としてよく知られていますが、過栄養摂取により生じる代謝物にも反応するために、強い炎症を引き起こして生活習慣病の発症要因になってしまいます。
大阪大学 免疫学フロンティア研究センター (WPI-IFReC)の齋藤達哉准教授、審良静男教授(拠点長)らは、様々な自己成分による炎症の誘導に関わる自然免疫機構であるNLRP3インフラマソームの研究を行い、痛風の発症・炎症が進行するメカニズムの詳細を明らかにしました。
過栄養摂取により蓄積して痛風の発症要因となる尿酸結晶は、マクロファージなどの自然免疫担当細胞を強く刺激することにより、ミトコンドリアの損傷を引き起こします。ミトコンドリアの損傷は、健康・長寿に関わるSIRTファミリーに属する微小管機能の調節酵素SIRT2の活性低下につながります。SIRT2の活性低下は微小管を介したミトコンドリアの空間配置変動を引き起こし、損傷ミトコンドリアを介したNLRP3インフラマソームの活性化が強く促進されます。痛風治療薬であるコルヒチンは、微小管を作用標的としてミトコンドリアの空間配置変動を阻害することにより、NLRP3インフラマソームを介して発症する痛風の炎症症状を緩和すると考えられます。
研究の背景
生活スタイルの西洋化に伴い、痛風、動脈硬化や2型糖尿病などの生活習慣病が現代日本の社会問題となっています。NLRP3インフラマソームは、過栄養摂取が原因となって体内に蓄積する尿酸結晶、コレステロール結晶や遊離脂肪酸などの刺激性因子により活性化して炎症による組織傷害を引き起こす自然免疫機構であることから、生活習慣病の有力な治療標的と考えられており、精力的に研究が進められています。
本研究成果が社会に与える影響(本研究成果の意義)
・痛風の発症機序およびコルヒチンの抗炎症作用機序を解明
NLRP3インフラマソームの新たな活性化経路を同定することにより、尿酸結晶が痛風を引き起こすメカニズムの詳細を明らかにしました。特に、NLRP3インフラマソームの活性化における微小管の重要性を示す発見は、古くから痛風治療薬として用いられているコルヒチンが炎症性サイトカインの産生を抑制することにより痛風の症状を軽減することを示すものです。
・痛風をはじめとした生活習慣病の新規治療薬開発へはずみ
コルヒチンは微小管の機能全般を阻害するので細胞・組織への傷害性が強く、治療薬としての使用頻度は減少しています。私たちがNLRP3インフラマソーム活性化を促進する因子として同定したαチューブリンアセチル基転移酵素MEC17は、特定の微小管機能を調節する酵素であるため、コルヒチンに代わる副作用の少ない治療薬を開発する上での理想的な創薬標的と考えられます。また、NLRP3インフラマソームは2型糖尿病や動脈硬化の発症にも関わることが知られており、MEC17はこれらの生活習慣病における創薬標的としても期待されます。
・SIRTファミリーによる健康維持の新たな側面を解明
酵母長寿遺伝子Sir2のホモログであるSIRTファミリーは、哺乳類においても長寿に関わることが近年の研究から明らかとなり、注目を浴びています。私たちはSIRT2に関する解析を通じて、既に知られている代謝・細胞死・老化に加えて炎症の制御を行うことにより、SIRTファミリーが健康維持に重要な役割を果たすことを見出しました。
特記事項
本成果は2013年3月17日の午後6時(ロンドン時間)に「Nature Immunology」オンライン版に掲載されます。
本研究は、内閣府/日本学術振興会・最先端研究開発支援プログラム、科学研究費助成事業特別推進研究および戦略的創造研究推進事業CRESTの支援を受けて行われました。
研究の詳細
はじめに
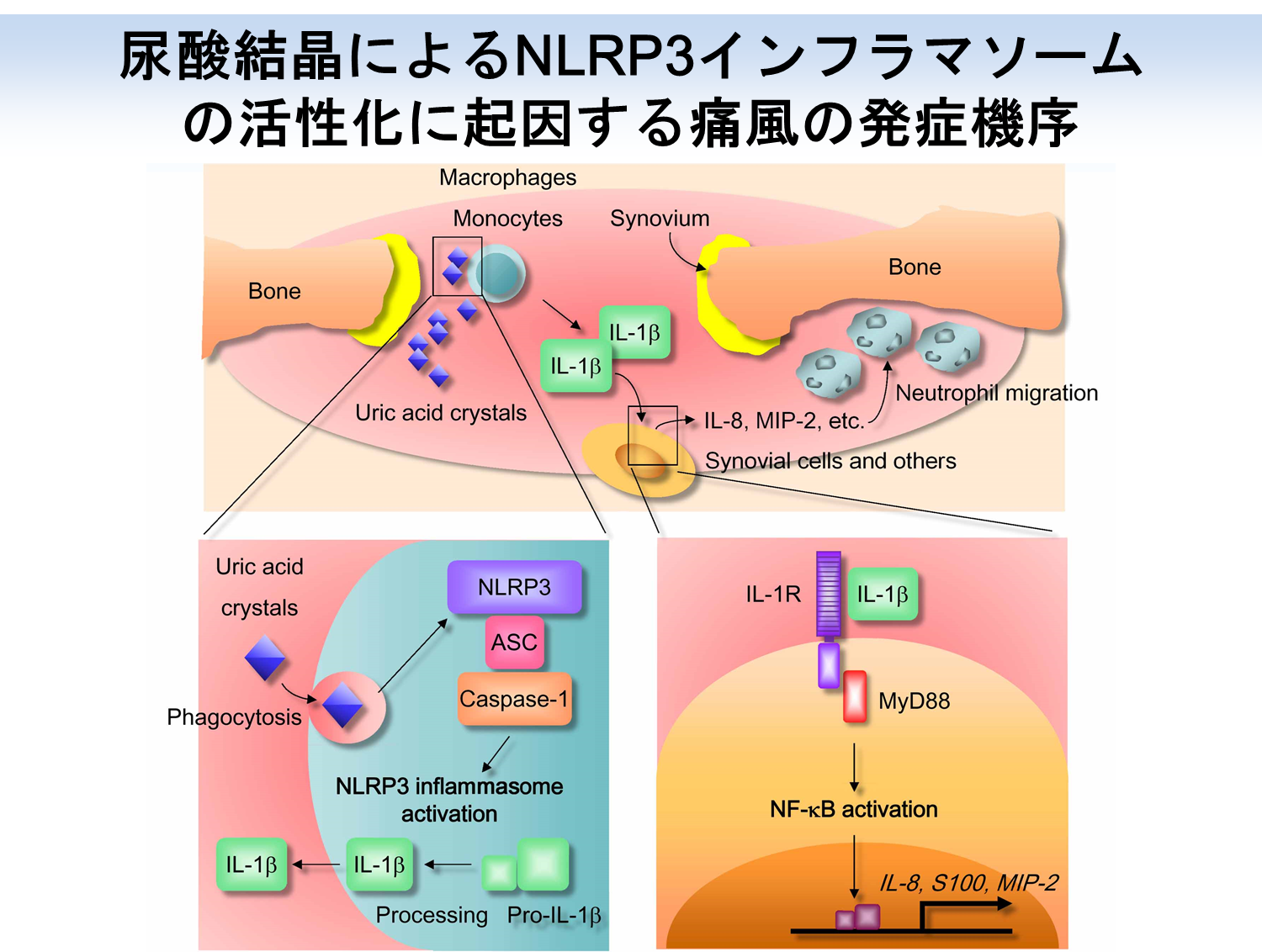
自然免疫機構は、病原性微生物の構成成分を認識して炎症性サイトカインやインターフェロンの産生を誘導し、感染症から身を守る役割を担う重要な感染防御機構です。しかしながら、自然免疫機構には自己成分を認識して活性化し、炎症性疾患を発症させる“負”の側面があることが近年の研究から明らかになってきました。自然免疫機構は、過栄養摂取により蓄積する代謝物に反応して過度の炎症による組織傷害を引き起こし、現代病の代表格といえる生活習慣病の発症要因となります。特に、尿酸結晶、コレステロール結晶や遊離脂肪酸などの代謝物により活性化する自然免疫関連受容体であるNLRP3は、生活習慣病の治療標的として注目されています。

NLRP3は、シグナル伝達因子ASCと共にNLRP3インフラマソームと呼ばれる複合体を形成して、プロテアーゼCaspase-1を介した炎症性サイトカインIL-1βやIL-18の成熟と産生を誘導します。このNLRP3インフラマソームの活性化は、マクロファージなどの貪食細胞において強く誘導されます。尿酸結晶やコレステロール結晶などを貪食した細胞においては、取り込まれた粒子の鋭利な部分によりリソソーム膜が損傷するため、リソソーム内容物が細胞内へ流入してミトコンドリアの損傷が起こります。貪食細胞から産生されたIL-1/IL-18は、周囲の細胞によるさらなるサイトカイン・ケモカイン産生やT細胞などの免疫細胞活性化を誘導するため、強い炎症を誘導して組織傷害を引き起こします。私たちはNLRP3インフラマソームの活性化に起因する炎症性疾患の研究に取り組んでおり(Saitoh et al., Nature, 2008)、現在はNLRP3インフラマソームを制御する化合物の同定とその作用機序の解明を行うことにより生活習慣病の治療法を開発することを目指しています。
本論
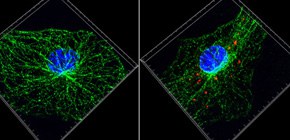
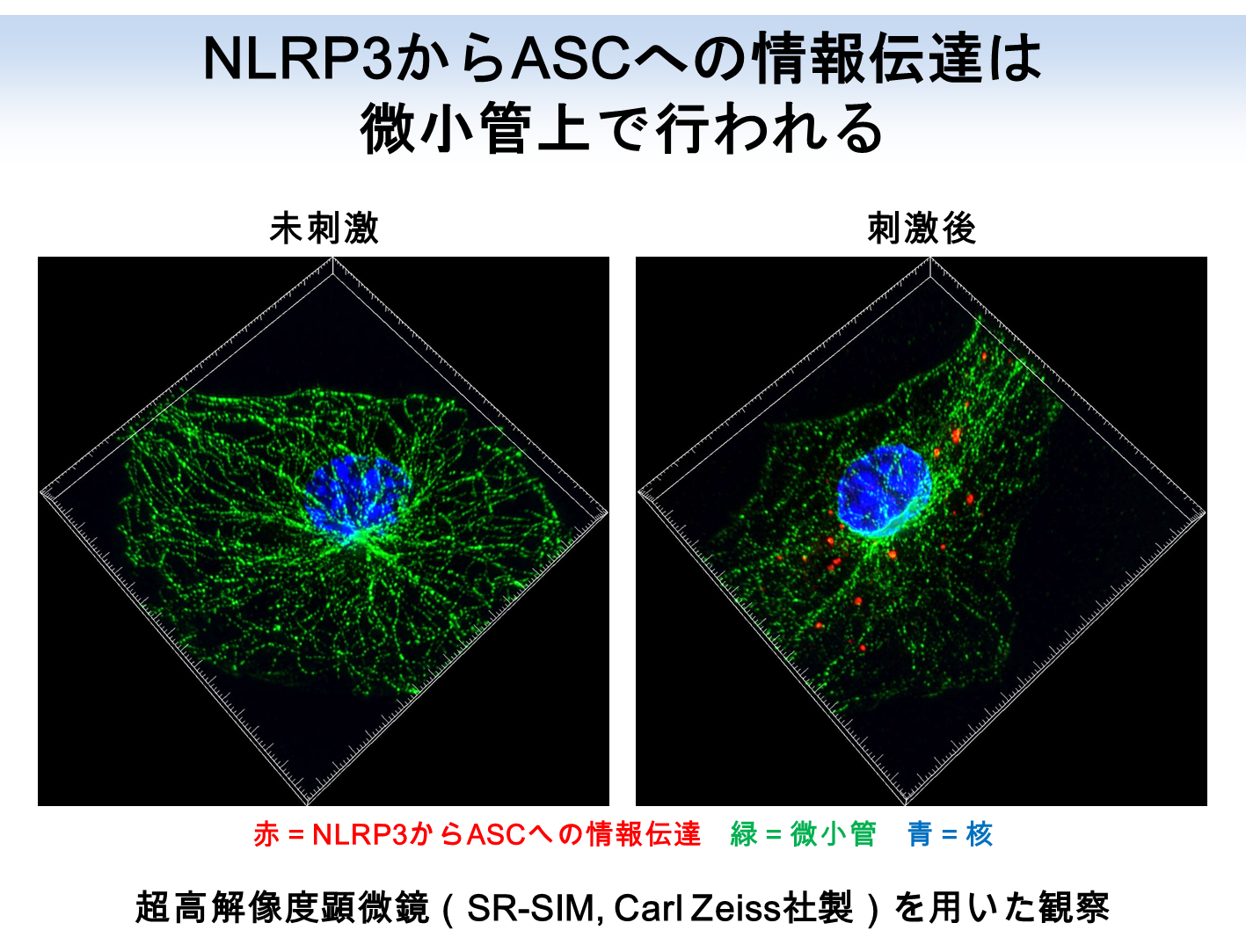
まず初めに私たちは、化合物ライブラリーを元に、NLRP3インフラマソームの活性化を抑制する化合物の探索を行いました。解析の結果、痛風治療薬として用いられているチューブリン重合阻害剤であるコルヒチンが、尿酸結晶刺激によるNLRP3インフラマソームの活性化を抑制することを発見しました。チューブリンは、細胞形態維持や細胞内物資輸送を行う細胞骨格である微小管の構成因子です。そこで、NLRP3インフラマソームを介した炎症応答において微小管が果たす役割の解明に取り組みました。これまでに私たちは、核・分泌顆粒・リソソーム(Saitoh et al., Cell Host Microbe. 2012)、脂肪滴(Saitoh et al., Immunity. 2011)、小胞体・ゴルジ体(Saitoh et al., PNAS. 2009)、オートファゴソーム(Saitoh et al., Nature. 2008)に関する研究を通じて、オルガネラが自然免疫の制御に関わることを示してきました。また海外の研究グループから、NLRP3インフラマソームの構成因子は刺激に応じて小胞体とミトコンドリアの近接領域に局在する、との報告もなされています。そこで私たちは、オルガネラの細胞内配置に関わる微小管の役割に着目することにしました。NLRP3とASCの細胞内局在を解析した結果、尿酸結晶刺激に応じて微小管を介したミトコンドリアの小胞体近傍へと移動・集積が誘導され、ミトコンドリア上のASCと小胞体上のNLRP3が近接することによりNLRP3インフラマソームが活性化することが明らかになりました。また、コルヒチンは微小管を介してNLRP3とASCが接近することを阻害することによりNLRP3インフラマソームを介した炎症を緩和することも明らかになりました。
次に私たちは、微小管上においてミトコンドリアの輸送を促進する因子の同定に取り組みました。細胞骨格を介した細胞内物資輸送は、キネシン、ダイニン、ミオシンといったモータータンパク質により行われます。モータータンパク質の中でもダイニンは、微小管中心方向への物資輸送に関わることが知られています。このダイニンに対する特異的な阻害剤を用いた解析から、尿酸結晶刺激に応じたミトコンドリアの移動とNLRP3-ASCの近接には、ダイニンが深く関わることが明らかになりました。急性痛風マウスモデルにおいてダイニン阻害剤を投与すると、尿酸結晶により誘導される炎症性サイトカインIL-1βの産生が顕著に減少します。
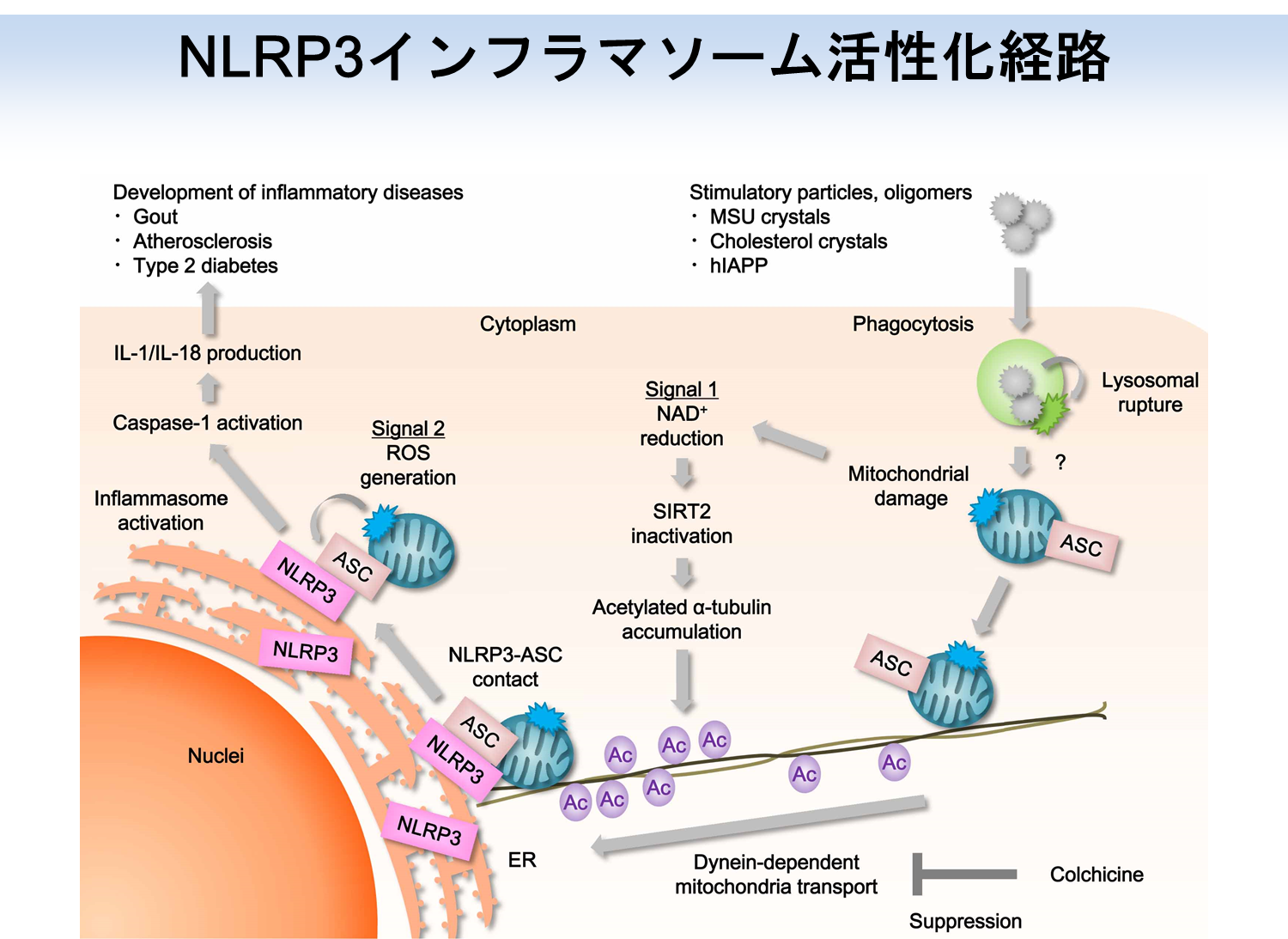
続いて私たちは、微小管を介したミトコンドリアの輸送が尿酸結晶刺激により亢進するメカニズムについての解析を行いました。微小管を介した細胞内物資輸送には、α-チューブリンの翻訳後修飾が深く関わることが知られています。そこでα-チューブリンの翻訳後修飾に着目して解析を進めたところ、尿酸結晶の刺激に応じてアセチル化されたα-チューブリンの量が増加することを見出しました。α-チューブリンのアセチル化転移酵素であるMEC17がミトコンドリアの移動とNLRP3-ASCの近接に関わることから、アセチル化α-チューブリンがNLRP3インフラマソームの活性化を促進することも明らかになりました。さらに私たちは、尿酸結晶刺激に応じてアセチル化α-チューブリンの量が増加するメカニズムについての解析を行いました。α-チューブリンの脱アセチル化を行う酵素として、健康・長寿に関わるSIRTファミリーに属するSIRT2が同定されています。SIRT2が機能するためにはNicotinamide adenine dinucleotide (NAD)が必要となりますが、尿酸結晶で刺激した細胞においてはミトコンドリアが傷害を受けて細胞内NADレベルが低下するため、SIRT2の活性が失われた状態になります。このSIRT2の失活によりアセチル化αチューブリンが蓄積し、微小管上のダイニン依存的なミトコンドリアの輸送とNLRP3-ASCの近接が引き起こされるために、NLRP3インフラマソームが活性化すると考えられます。
おわりに
本研究により、NLRP3インフラマソームの活性化は、以前から知られているNLRP3を直接的に刺激する経路に加えて、NLRP3インフラマソームの形成を促進する微小管を介した経路が活性化することにより、効率よく誘導されることが明らかになりました。また、コルヒチンはNLRP3インフラマソームの活性化を抑制することにより、尿酸結晶に起因する痛風の疾患症状を緩和することも明らかになりました。微小管は様々な細胞応答に関わる鍵となる器官であるために、その機能全般を阻害するコルヒチンには細胞・組織の傷害を惹起する副作用があります。私達がNLRP3インフラマソーム活性化の促進因子であることを見出したMEC17は、αチューブリンのアセチル化という特定の翻訳後修飾を司る酵素であるため、微小管を標的とし、かつ副作用の少ない痛風治療薬を開発するための有力な創薬標的と考えられます。今後は、尿酸結晶によってミトコンドリア傷害が引き起こされる分子機序を解明すると共に、微小管を標的として特異的にNLRP3インフラマソームの活性化を抑制する手法の開発に取り組んでいきます。
謝辞
本研究は、最先端研究開発支援プログラム(審良静男が受給)、科学研究費助成事業特別推進研究(審良静男が受給)および戦略的創造研究推進事業CREST(齊藤達哉が受給)による補助を受けて行われました。本研究には、理化学研究所NPDepo(斎藤臣雄博士・長田裕之博士)から供与された化合物ライブラリーを使用しました。
発表論文
欧文タイトル:
“Microtubule-driven spatial mitochondria arrangement promotes NLRP3-inflammasome activation”
邦文タイトル:
「微小管を介したミトコンドリアの空間配置調節はNLRP3インフラマソームの活性化を促進する」
雑誌:Nature Immunology
