知られざるグリコーゲン分解酵素の多様性が明らかに
「古株モデル酵素」に新たな活性調節機構を発見
研究成果のポイント
- 腸内細菌の種類の違いによってグリコーゲン分解に関わる酵素の分子会合状態が異なることと会合状態を変化させることで酵素活性を調節していることを発見
- クライオ電子顕微鏡(Cryo-EM)を用いて腸内細菌由来のグリコーゲン分解酵素を解析することで、これまで見逃されていた構造・機能的多様性の可視化を可能に
- 腸内細菌叢の個人差が糖代謝に与える影響について明らかになり、個別化医療のための基盤構築に期待
概要
大阪大学薬学部の菖蒲啓悟さん(研究当時:学部6年)、髙井真由さん(学部5年)、同大学院薬学研究科の谷野弘樹特任研究員、福田庸太助教、井上豪教授らの研究グループは、グリコーゲンホスホリラーゼ (GP)の分子会合状態が腸内細菌の種類によって異なり、酵素活性の調節機構もそれぞれ異なることを発見しました。
グリコーゲンは、細胞のエネルギー源であるグルコースが繋がった巨大分子で、必要に応じてGPによって分解されます。今回、古典的な大腸菌由来GP(EcGP)と新規に見いだされたSegatella copri由来GP (ScGP)とDorea longicatena由来GP (DlGP) を対象に、これら3種類のGPの構造や働き方の違いを、Cryo-EM等により分子構造を解析することで解明しました。
これは長年研究されてきたGPの活性調節に関する従来の機構を刷新する成果であり、患者の腸内細菌叢の違いを反映した個別化医療へむけた新たな知見を提供するものです。
本研究成果は、米国科学誌「米国科学アカデミー紀要」に、2月10日(火)5時(日本時間)に公開されました。
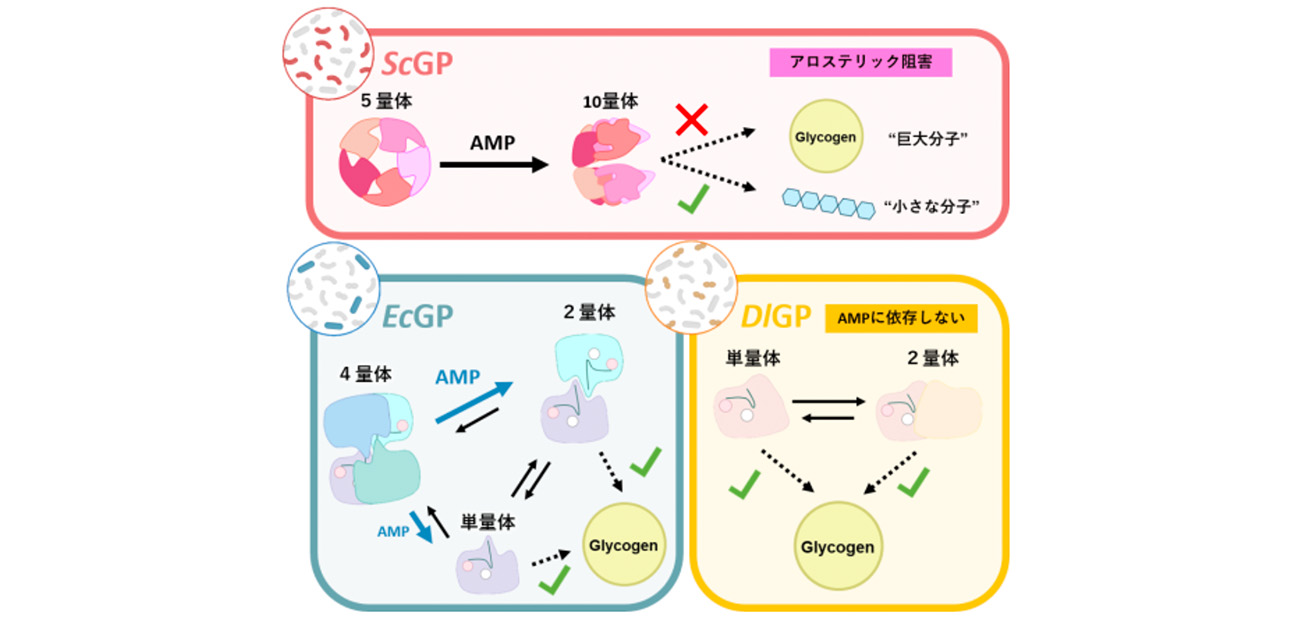
図1. 腸内細菌由来GPの多様性。腸内細菌の種類が異なるとGPの構造やアデノシン一リン酸(AMP)の結合による活性調節機構が全く異なることが明らかになった。
研究の背景
グリコーゲンは、細胞のエネルギー源であるグルコースが繋がった巨大分子で、必要に応じてGPによって分解されます。20世紀前半に基本的な機能が解明されて以来、GPはアロステリック機構を示す酵素のモデルとして、生化学の礎を築いてきました。例えば哺乳類や大腸菌のGPでは、アデノシン一リン酸(AMP)という化合物が結合するとタンパク質内の局所的構造変化が誘起され、基質が結合しやすくなることで活性が上昇するとされています。
一方、腸内細菌はヒトの健康と密接に関係し、腸内細菌叢の乱れは様々な疾患に関与しています。近年の研究で、腸内細菌が生成するグルコースのような糖が、2型糖尿病におけるインスリン感受性と関連することが示されています。これは腸内細菌の種類によって糖生成量が異なるためですが、腸内細菌内で糖を生成するGPを含む様々な酵素の構造や機能には未解明な点が多い状況でした。
研究の内容
様々な腸内細菌が持つGPの系統関係を解析すると、宿主のインスリン感受性を増強あるいは減弱する腸内細菌のGPは、これまで研究されてきた哺乳類や大腸菌由来のGPと異なる系統に属することが判明しました。そこで、古典的な大腸菌由来GP (EcGP)に加え、新規に見出されたGPの代表としてSegatella copri由来GP (ScGP)とDorea longicatena由来GP (DlGP) を対象にし、これらの構造や機能を比較することにしました。
古典的なEcGPではAMP添加による活性上昇を確認できた一方、ScGPではAMP添加で酵素活性が低下し、DlGPでは変化がないという結果になりました。そこで、この予期せぬ反応性の違いを分子レベルで解明するため、各GPについて、Cryo-EMやX線結晶構造解析を用いて立体構造を決定しました。
立体構造を決定したところ、ScGPはScGP分子が5つ集まった5量体を形成し、グリコーゲンと効率的に結合できる構造を取っていましたが、AMPを添加すると口を開いた二枚貝のような見た目の10量体構造が現れました。グリコーゲンはこの「貝の口」より大きく、活性中心に近づけないため、AMPの結合によって10量体化することが、ScGPにおけるグリコーゲン分解活性低下の理由だと考えることができます(図1上段)。
一方、EcGPは通常時、4分子あるいは2分子が会合した4量体や2量体として存在していました。この4量体はグリコーゲンとうまく結合できない構造でしたが、AMP存在下では4量体の割合が低下し、2量体や1分子単独で存在する単量体の割合が増加しました。つまりEcGPではScGPとは対照的に、AMPが結合すると会合状態が解消され、グリコーゲンと結合しやすくなることで活性が上昇するのだと考えることができます(図1下段左)。
また、AMPによる影響を受けなかったDlGPは主に単量体として存在し、一部2量体も観察されましたが、これらの割合はAMPに依存しませんでした。つまり、DlGPは常に活性型の単量体として存在すると考えることができます(図1下段右)。
これらは、腸内細菌のGPの構造が従来考えられていたより多様であり、古典的な活性調節機構に加え、会合状態の違いを利用した、種依存的で多彩な活性調節機構も持つことを明らかにした非常に重要な発見です。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、生化学の礎を築いてきたGPのアロステリック機構が刷新され、新たな酵素生物学の発展が期待されます。また基礎的な代謝酵素の活性調節機構が腸内細菌の種類によって全く異なることを明らかにした本研究は、腸内細菌叢の違いがヒトの健康に及ぼす影響の分子レベルでの理解にも繋がります。
特記事項
本研究成果は、2026年2月10日(火)5時(日本時間)に米国科学誌「米国科学アカデミー紀要」(オンライン)に掲載されました。
タイトル:“Structural and mechanistic diversity of glycogen phosphorylases from gut bacteria”
著者名:Keigo Shobu†, Mayu Takai†, Hiroki Tanino, Yohta Fukuda*, Tsuyoshi Inoue*
(†貢献度の等しい筆頭著者、*責任著者)
DOI:https://doi.org/10.1073/pnas.2518513123
本研究は、日本学術振興会科学研究費助成事業(22K05442, 25K08921, 22H02557, 25K02216)、生命科学・創薬研究支援基盤事業プラットフォーム(JP24ama121003, JP25ama121003, JP24ama121004)の支援を得て行われました。また、X線回折実験は構造解析共同利用研究課題として大阪大学蛋白質研究所生体超分子複合体構造解析ビームライン(2024A6928, 2024B6928, 2025A6524)で実施しました。
参考URL
SDGsの目標
用語説明
- クライオ電子顕微鏡(Cryo-EM)
電子顕微鏡を用いて、ガラス状の薄氷の中に閉じ込めた分子を極低温下で観察し、分子の立体構造を決定する手法。本手法の開発で中心的な役割を担ったJacques Dubochet、Joachim Frank、Richard Hendersonに2017年のノーベル化学賞が授与されている。
- グリコーゲンホスホリラーゼ(GP)
グリコーゲンからグルコース1リン酸の形でグルコース単位を切り出す酵素。グリコーゲン分解の中心的役割を担う本酵素の機能解明を含む研究で、Gerty CoriとCarl Coriに対して1947年にノーベル生理学・医学賞が贈られている。
- アロステリック機構
化学反応がおこる活性中心から離れた場所にエフェクターと呼ばれる分子が結合することで、酵素反応が促進あるいは抑制される調節メカニズム。GPはアロステリック機構を示す酵素として世界で初めて発見された。
- X線結晶構造解析
分子の立体構造を正確に決定するための手法。結晶試料にX線を照射し、結晶によって回折されたX線の回折強度分布から分子の外形を示す電子密度を計算でき、ひいては分子の立体構造を決定することができる。

