結核菌が免疫受容体を利用して生き残る仕組みを解明
免疫の働きを逆手に取る抗酸菌の生存戦略
研究成果のポイント
概要
大阪大学微生物病研究所、免疫学フロンティア研究センター、感染症総合教育研究拠点、ワクチン開発拠点先端モダリティ・DDS研究センターの研究グループは、結核菌が宿主の免疫受容体Dectin-1を利用して免疫を回避し、細胞内での生存を促進していることを明らかにしました。
私たちの体には、病原体を感知するためのセンサーである「免疫受容体」が備わっており、免疫受容体により病原体を認識して免疫反応を活性化し、排除します。Dectin-1はC型レクチン受容体と呼ばれる免疫受容体の一つで、主に免疫細胞に発現し、侵入した病原体の認識と排除に関わることが知られています。
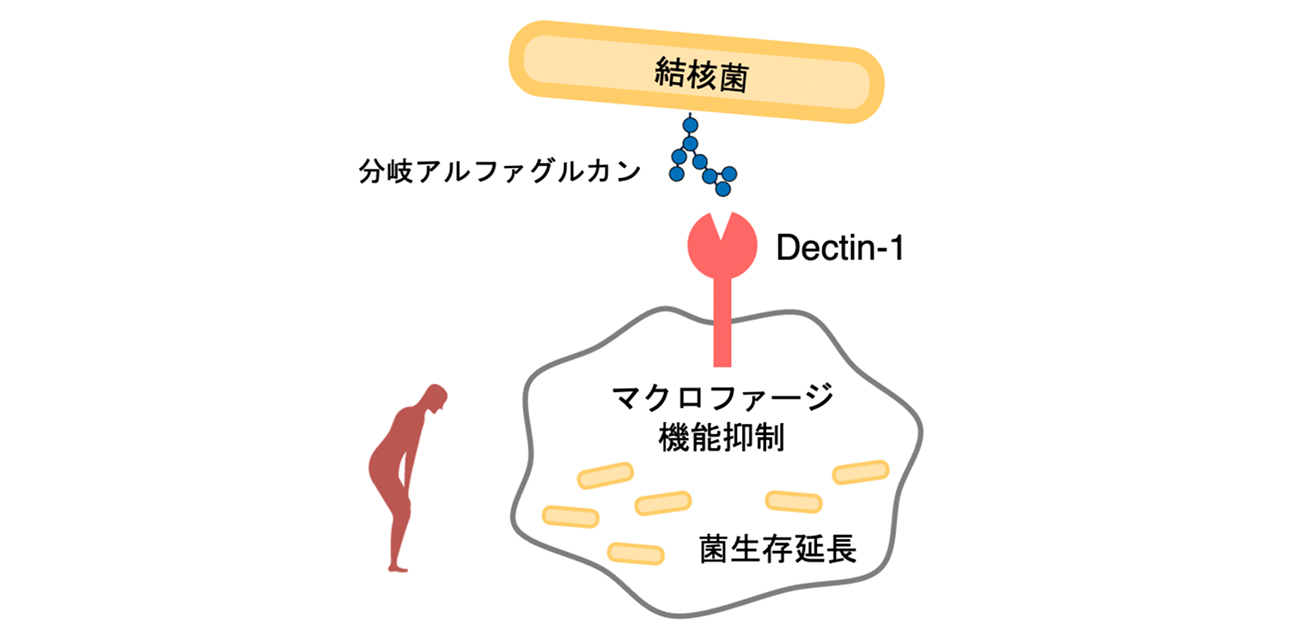
しかし、本研究では、結核菌が持つ特定の糖鎖構造「分岐型α-グルカン」がDectin-1に認識されると細菌を分解する免疫細胞の細胞内経路が抑制され、結果として結核菌が排除されずに生き残りやすくなることを示しました。
この免疫受容体を利用した生存戦略は、結核菌だけでなく、BCGワクチン株を含む複数の抗酸菌に共通して見られることが分かりました。本研究成果は、免疫が働いているにもかかわらず結核菌が排除されにくい理由について、その分子メカニズムの一端を明らかにするものであり、将来的な感染制御や治療法開発につながる可能性を示す知見です。
本研究成果は、米国科学誌「Science Immunology」に2026年1月10日(土)午前4時(日本時間)に掲載されました。
図. 結核菌の分岐アルファグルカンが免疫受容体Dectin-1に結合すると、正常なマクロファージ機能が抑制されてしまい、菌の生存延長が促される
研究の背景
結核は、現在も世界で年間約150万人の命を奪う深刻な感染症であり、感染後に宿主免疫が活性化しているにもかかわらず、病原体が長期間体内で排除されずに生存し続けることが大きな特徴です。結核菌は主にマクロファージに取り込まれて細胞内で生存・増殖しますが、その過程で宿主の免疫機構を巧みに操作し、免疫による排除を回避していることが知られています。しかし、結核菌がどのような分子機構によって免疫を操作しているのか、その詳細は十分に解明されていませんでした。
Dectin-1はC型レクチン受容体と呼ばれる病原体センサー(免疫受容体)の一つで、病原体が持つ糖鎖構造を認識し、免疫反応を引き起こします。特に、Dectin-1は真菌が持つβ-グルカンを認識する受容体としてよく知られていますが、近年では細菌感染においても免疫応答に関与する可能性が示唆されてきました。しかし、結核菌を含む抗酸菌はβ-グルカンを持たないため、Dectin-1がどのように抗酸菌を認識し、感染の経過にどのような影響を与えているのかについては、その実態が不明のままでした。
研究の内容
本研究では、結核菌感染における免疫受容体Dectin-1の役割を明らかにするため、マウス感染モデルを用いて解析を行いました。Dectin-1を欠損したマウスに結核菌を感染させたところ、野生型マウスと比較して生存率が高く、肺内の結核菌量や炎症性免疫細胞の集積が有意に低下していることが明らかになりました。この結果から、Dectin-1は結核菌感染において防御的に働くのではなく、むしろ結核菌が体内で生き残りやすくなる方向に働いている可能性が示されました。
次に、結核菌を取り込むマクロファージについて、培養系を用いて解析しました。Dectin-1を持つマクロファージでは、結核菌が細胞内でより長く生存する一方、Dectin-1を欠損したマクロファージでは、細胞内で結核菌の分解が促進されることが分かりました。さらに、Dectin-1が活性化すると、菌を取り込んだ後に分解するために重要なファゴソーム成熟といった、細菌の分解に関わる細胞内経路が抑制されていることを明らかにしました。
さらに、Dectin-1がどのように結核菌を認識しているのかを探索した結果、結核菌の細胞壁に存在する「分岐型α-グルカン」がDectin-1に結合することを明らかにしました。この分岐型α-グルカンはDectin-1を活性化するために必須であり、分岐構造を欠くα-グルカンを持つ菌株では、マクロファージ内での生存促進が起こらないことも分かりました。
加えて、このDectin-1を介した生存促進機構は、結核菌だけでなく、BCGワクチン株や病原性のない抗酸菌においても共通して見られることを示しました。これらの結果から、結核菌は分岐型α-グルカンを用いて宿主の免疫受容体Dectin-1を利用し、免疫による排除を回避して細胞内での生存に有利な環境を作り出していることが明らかになりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、結核菌が宿主の免疫機構から単に逃避するのではなく、免疫受容体Dectin-1を利用して細胞内での生存に有利な環境を作り出していることを明らかにしました。これは、免疫が働いているにもかかわらず結核菌が排除されにくい理由について、その分子メカニズムの一端を明らかにしたものです。
これまでDectin-1は、病原体の感染に対する防御的な免疫応答を担う受容体として理解されてきましたが、本研究により、同じ免疫受容体が病原体の種類や分子構造によっては、逆に感染の成立を助ける方向に働き得ることが示されました。この知見は、自然免疫受容体の役割が一様ではなく、病原体との相互作用の文脈によって大きく変化することを示す重要な例となります。
また、本研究で明らかになったDectin-1と分岐型α-グルカンとの相互作用は、結核菌が宿主免疫を利用して生存する分子基盤の一つであり、この相互作用を制御・阻害することで、将来的に新たな感染制御や治療法の開発につながる可能性も示唆されます。さらに、この仕組みが複数の抗酸菌で共通して見られることから、抗酸菌感染全体の理解にもつながると考えられます。
特記事項
本研究成果は、2026年1月10日(土)午前4時(日本時間)に米国科学誌「Science Immunology」に掲載されました。
タイトル:“Mycobacterial α-glucans hijack Dectin-1 to facilitate intracellular bacterial survival”
著者名:Shota Torigoe, Sumayah Salie, Roanne Keeton, Beren Aylan, Ben J. Appelmelk, David L. Williams, Douglas W. Lowman, Toshihiko Sugiki, Sohkichi Matsumoto, Akira Kawano, Satoru Mizuno, Kazuhiro Matsuo, Jonas N. Søndergaard, James B. Wing, Maxine Hoft, Romey Shoesmith, Mthawelanga Ndengane, Anna K. Coussens, Janet A. Willment, Maximiliano G. Gutierrez, Jennifer Claire Hoving, *Sho Yamasaki and *Gordon D. Brown
DOI:10.1126/sciimmunol.adw0732
なお、本研究は、AMED創薬基盤推進研究事業、AMED新興・再興感染症研究基盤創生事業、AMED革新的先端研究開発支援事業、文部科学省学術変革領域研究(A)、日本医療研究開発機構 先進的研究開発戦略センター(AMED SCARDA)ワクチン開発のための世界トップレベル研究開発拠点の形成事業「ワクチン開発のための世界トップレベル研究開発拠点群大阪府シナジーキャンパス(大阪大学ワクチン開発拠点)」(JP223fa627002)の一環として行われ、国立感染症研究所、University of Cape Town、Francis Crick Institute、Amsterdam University Medical Centers、East Tennessee State University、大阪大学蛋白質研究所、新潟大学、三重大学、北海道大学、Walter and Eliza Hall Institute、千葉大学、九州大学、University of Exeter、Harvard Medical Schoolとの国際共同研究として行われました。
参考URL
SDGsの目標
用語説明
- 免疫受容体
病原体などの侵入を感知するために免疫細胞が持つ分子。一般に病原体を認識すると免疫反応を活性化し、排除を促す。
- Dectin-1
免疫受容体の一つ。主にマクロファージなどの免疫細胞に発現し、病原体が持つ糖鎖構造を認識する。
- 分岐型α-グルカン
結核菌などの抗酸菌が持つ糖鎖構造。本研究では、免疫受容体Dectin-1に認識される分子として同定された。
- C型レクチン受容体
糖鎖構造を認識する免疫受容体の一群。自然免疫において病原体の認識や免疫応答の調節に関与する。
- ファゴソーム成熟
免疫細胞が取り込んだ病原体を分解するために、細胞内小器官が変化・発達していく過程。

