細胞内でUV-DDBタンパク質がゲノム上の紫外線損傷を 修復する瞬間の可視化に成功
色素性乾皮症の発症基盤解明へ向けて前進
研究成果のポイント
- ゲノムDNAに生じた紫外線損傷に結合するDNA修復タンパク質(UV-DDBタンパク質)を細胞から単離し、クライオ電子顕微鏡で解析することで、細胞内で紫外線損傷が修復される様子の可視化に初めて成功しました。
- これまでゲノムDNAの紫外線損傷に関する修復過程には不明な点が多く、細胞内でその過程を直接観察することは困難でした。本研究により、その修復過程を細胞内で明らかにするための新しい技術基盤が確立されました。
- 今回対象としたUV-DDBタンパク質は、難治性疾患である色素性乾皮症の原因因子であることが知られています。色素性乾皮症には現時点で根本的な治療法が存在しないため、本研究成果は将来的な治療法開発につながることが期待されます。
ChIP-CryoEM法によるUV-DDBタンパク質の可視化の概要
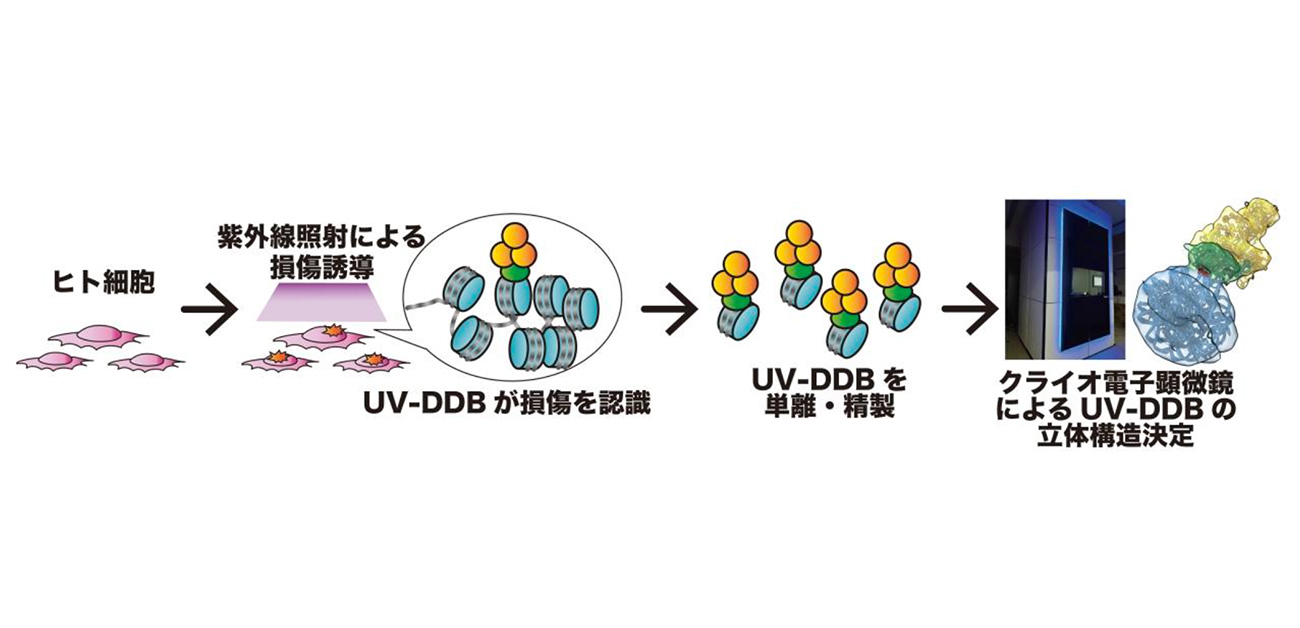
概要
東京大学定量生命科学研究所の松本翔太助教、胡桃坂仁志教授ら、神戸大学バイオシグナル総合研究センターの菅澤薫教授、大阪大学大学院基礎工学研究科の岩井成憲名誉教授、山元淳平准教授の研究グループは、細胞内でゲノムDNA上の紫外線損傷を修復中のUV-DDBタンパク質複合体の立体構造を可視化することに成功しました。
本研究では、胡桃坂教授らが開発した細胞内タンパク質を可視化する独自技術「ChIP-CryoEM」を応用し、DNA修復タンパク質として知られるUV-DDBタンパク質が紫外線損傷に結合した構造を初めて明らかにしました。これまでの先行研究と異なり、細胞内からUV-DDBタンパク質を直接単離して構造を捉えた点に新規性があります。本成果は、色素性乾皮症をはじめDNA修復異常に起因する難治性遺伝病の理解と治療法開発につながることが期待されます。
研究の内容
これまでUV-DDBタンパク質は、色素性乾皮症の原因因子であり、ゲノムDNAなどの紫外線損傷の修復に重要な役割を担うことが知られていました。ゲノムDNAは細胞内でヒストンに巻き付いてクロマチン構造を形成しており、その複雑な構造環境下で紫外線損傷をどのように修復するのかについては、多くの点が未解明のままでした(図1)。
図1. 細胞内においてゲノムDNAが形成するクロマチン構造
本研究チームは、細胞内でのDNA修復機構の解明に挑み、クロマチン免疫沈降法(ChIP: Chromatin immunoprecipitation)とクライオ電子顕微鏡解析(Cryo-EM: Cryo-electron microscopy)を組み合わせた独自技術「ChIP-CryoEM」をUV-DDBタンパク質に応用しました。その結果、ヌクレオソーム上の紫外線損傷に結合したUV-DDB複合体を直接単離し、その立体構造の解明に初めて成功しました。これにより、UV-DDBタンパク質がヌクレオソーム上という構造的に複雑な環境下においても、ヒストンによる立体阻害をほとんど受けることなく、ヌクレオソーム上のDNA損傷に対して、直接認識して結合することが明らかとなりました(図2)。
図2. ChIP-CryoEM法により可視化した細胞内ヌクレオソーム上の紫外線損傷に結合したUV-DDBタンパク質の立体構造
さらに、UV-DDBタンパク質が紫外線損傷に結合する様子を高精細に観察し、代表的な紫外線損傷であるシクロブタン型ピリミジン二量体(CPD)に対する結合構造の詳細を初めて明らかにしました。UV-DDBタンパク質の二箇所のアミノ酸残基が、CPD損傷に特異的に相互作用することで、ヌクレオソーム上のCPD損傷を直接認識して結合することが見出されました。これにより、細胞内で紫外線損傷がどのように認識され、修復されるのかという分子基盤が解明されました(図3)。
図3. 紫外線損傷CPDに結合したUV-DDBの詳細な立体構造
今回の成果は、紫外線損傷にとどまらず、電離放射線や有害物質によるDNA損傷修復研究への応用可能性も持ち、ゲノムDNA全体の修復機構の理解に大きく寄与することが期待されます。DNA修復機構の異常は色素性乾皮症をはじめとする難治性遺伝病の主要な発症要因であり、本研究成果はその分子基盤の解明と治療法開発に大きく貢献する可能性があります。これらを通じて、本成果は難病克服に向けた重要かつ画期的な一歩となることが望まれます。
特記事項
【論文情報】
雑誌名:Nature Communications
題 名:Structural basis of cyclobutane pyrimidine dimer recognition by UV-DDB in the nucleosome
著者名:Syota Matsumoto(松本翔太), Yoshimasa Takizawa(滝沢由政), Mitsuo Ogasawara(小笠原光雄), Kana Hashimoto(橋本佳那), Lumi Negishi(根岸瑠美), Wenjie Xu(許文杰), Haruna Tachibana(橘春奈), Junpei Yamamoto(山元淳平), Shigenori Iwai(岩井成憲), Kaoru Sugasawa(菅澤薫), ◯Hitoshi Kurumizaka(胡桃坂仁志)
DOI: 10.1038/s41467-025-65486-5
本研究は、日本学術振興会(JSPS)の科研費(課題番号:JP22K18034、JP22K06098、JP23H05475、JP24H02328、JP24H02319)、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ(課題番号:JPMJPR2288)、同CREST(課題番号:JPMJCR24T3)、同 ERATO(課題番号:JPMJER1901)、ノバルティス科学振興財団のノバルティス研究奨励金、住友財団の基礎科学研究助成、日本医療研究開発機構(AMED)の生命科学・創薬研究支援基盤事業(BINDS)(課題番号:JP24ama121009、JP24ama121002)の支援により実施されました。
用語説明
- UV-DDBタンパク質
DNAに生じた紫外線損傷に特異的に結合するタンパク質複合体。DDB1とDDB2の二つのサブユニットから構成され、DDB2は損傷DNAに直接結合する活性を持つ。DDB2は、色素性乾皮症E群の原因遺伝子産物として同定されている。
- 色素性乾皮症
DNA修復機構の一つであるヌクレオチド除去修復が先天的に欠損することで発症する遺伝性難病。厚生労働省の指定難病(特定難病159)に分類されている。特徴的な症状として光線過敏症や皮膚がんの高発が知られており、一部の症例では神経変性疾患を伴うこともある。現時点で根本的な治療法はなく、対症療法に限られているため、新たな治療法の開発が強く望まれている。
- クロマチン構造
ゲノムDNAが細胞内で折り畳まれて形成される三次元構造。DNAを効率的に収納する役割に加え、必要に応じて構造を変化させることで、遺伝子の働きを調節する機能を担っている。
- クロマチン免疫沈降法(ChIP: Chromatin immunoprecipitation)
生細胞内で特定のタンパク質と結合しているゲノムDNAをクロマチンごと単離する技術。タンパク質とDNAを架橋固定し、クロマチンを断片化した後、目的タンパク質に結合する抗体を用いて複合体を回収する。遺伝子発現制御やエピジェネティクス研究(遺伝子を使うかどうかを制御するスイッチのオン・オフのしくみ、またはそのしくみに関する研究分野のこと)に広く活用されている。
- クライオ電子顕微鏡(Cryo-EM: Cryo-electron microscopy)
試料を非結晶の氷中に封入し、極低温下で電子線を照射して高解像度の画像を取得する透過型電子顕微鏡。コンピューターによる画像解析と組み合わせることで、タンパク質などの立体構造を高精度に決定できる。
- ヌクレオソーム
4種類のヒストンタンパク質(H2A、H2B、H3、H4)からなる複合体にDNAが巻き付いた構造単位。数珠状に連なったヌクレオソームが集まり、クロマチン構造を形成している。
- シクロブタン型ピリミジン二量体(CPD)
紫外線の照射によってDNAに生じる代表的な損傷の一つ。DNA中のチミン塩基が隣同士で架橋され、異常な立体構造をつくることで、DNAの正常な機能を妨げる。この損傷は遺伝子変異や細胞のがん化につながる要因となる。
