薬の滞在時間を制御するメカニズムを解明
受容体の「ふた」が鍵に
研究成果のポイント
- 薬の効き方や効果の持続時間を決定する重要な指標となる、薬物の「滞在時間」を規定するメカニズムを解明
- 磁気共鳴法(NMR法)、分子動力学法、フラグメント分子軌道法(FMO法)を統合した解析により、代表的なGタンパク質共役型受容体(GPCR)であるアデノシンA2A受容体の構造を観察し、滞在時間が短い場合に薬物結合部位の「ふた」の構造が乱れることを解明。また、その構造的特徴と分子間相互作用の可視化に成功
- 滞在時間を調整した薬物設計を効率化し、病気の治療目的に応じた最適な薬物の開発につながることに期待
概要
大阪大学大学院薬学研究科の上田卓見教授、白石勇太郎特任講師(常勤)、福澤薫教授、宮川柊兵さん(博士後期課程)、および理化学研究所の嶋田一夫グループリーダー、今井駿輔上級研究員、東京大学の竹内恒教授、幸福裕講師らの研究グループは、薬の効果を左右する「滞在時間」という重要な要素に着目し、代表的なGタンパク質共役型受容体(GPCR)であるアデノシンA2A受容体と薬物の反応を詳しく解析することで、薬物の滞在時間を規定するメカニズムを解明しました。滞在時間とは、薬が体内で受容体にくっついている間の時間を指し、薬の効き方や効果の持続時間を決定する重要な指標です。
研究グループは、動的構造解析技術であるNMR法により、滞在時間の違いによるアデノシンA2A受容体の立体構造上の違いを観察しました。特に、薬物結合部位の「ふた」の役割をするアミノ酸残基(アスパラギン酸169番とヒスチジン264番)と、それを反映するシグナルとしてアラニン265番の構造変化に着目することで、滞在時間が短い場合、この「ふた」の構造が乱れることを明らかにしました。さらに、分子動力学計算とフラグメント分子軌道法(FMO法)を用いた計算により分子間の相互作用を可視化しました。
本研究の成果は、滞在時間を調整した薬物の設計を効率化し、病気の治療目的に応じた最適な薬物の開発につながると期待されます。また、今回の知見は、アデノシンA2A受容体以外のGPCRにも応用可能であり、新たな創薬手法の基盤となる成果といえます。
本研究成果は、英国王立化学会が発行する、投稿料免除のフラッグシップジャーナルである「Chemical Science」 誌に8月29日に掲載されました。
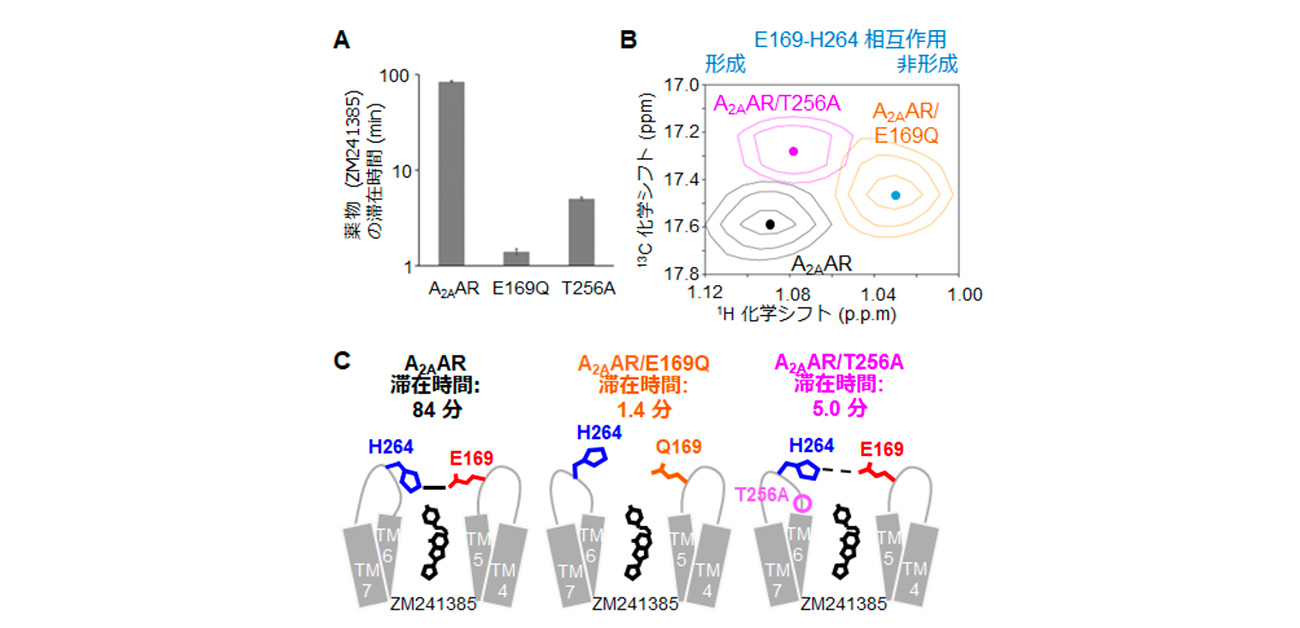
図1. A. アデノシンA2A受容体および変異体と薬物の滞在時間。 B. 塩橋近傍の構造を反映する、265番目のアラニン残基に由来するNMRシグナルの重ね合わせ。 C.滞在時間を規定する構造的特徴の模式図。
研究の背景
薬物は体内で受容体と結合・解離を繰り返しながら作用を示します。薬物と受容体の複合体が解離するまでの時間を滞在時間と呼び、これは薬効およびその持続性を左右する重要な要素です。例えば、血管拡張や炎症反応制御、運動を司る神経伝達に関与するアデノシンA2A受容体を標的とする薬物の場合、心筋の画像診断用の薬は短い滞在時間が迅速な排出の上で有利である一方、パーキンソン病や炎症に対する薬としては滞在時間が長い方が薬効が持続して有利です。理想的な滞在時間の薬物を開発する上では、滞在時間が異なる状態の薬物-受容体複合体の立体構造を明らかすることが不可欠です。しかし、滞在時間が短い薬物-受容体複合体の立体構造解析は難しく、滞在時間を規定する構造的要因は解明されていませんでした。
研究の内容
研究グループは、動的に交換する立体構造を実験的に解析できるNMR法を用いて、滞在時間が異なる条件下でのアデノシンA2A受容体の構造を解析しました。薬物結合部位上方で相互作用して蓋を形成する169番目のアスパラギン酸残基と264番目のヒスチジン残基の構造を反映する、265番目のアラニン残基に由来するNMRシグナルを観測した結果、滞在時間が減少するT256AおよびE169Q変異体では蓋の構造が乱れることが明らかになりました(図1)。さらに、分子動力学法とフラグメント分子軌道法(FMO法)による計算で、これらの構造的特徴と分子間相互作用を可視化することに成功しました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、滞在時間を最適化した薬物の設計が可能となり、望ましい薬効を持つ薬物開発の推進が期待されます。他のGPCRにおいても、分子動力学法に基づく計算により、薬物結合部位上方の構造が滞在時間と関係することが提唱されているため、本研究の成果は、アデノシンA2A受容体だけでなく、他の多くの薬物受容体における滞在時間の理解および創薬加速につながると期待されます。
特記事項
本研究成果は、2025年8月29日に英国王立化学会の「Chemical Science」誌に掲載されました。
タイトル:“Structural basis of the residence time of adenosine A2A receptor ligands revealed by NMR”
著者名:Takumi Ueda, Tomoki Tsuchida, Masatoshi Kurita, Takuya Mizumura, Shunsuke Imai, Yutaro Shiraishi, Yutaka Kofuku, Shuhei Miyakawa, Kaori Fukuzawa, Koh Takeuchi, Ichio Shimada
DOI:https://doi.org/10.1039/D5SC05338B
参考URL
用語説明
- 核磁気共鳴法(NMR法)
静磁場中に置かれた原子核の共鳴を観測する分光法。溶液中のタンパク質などの構造や運動性を分子レベルで解析可能。
- フラグメント分子軌道法(FMO法)
タンパク質や核酸などの生体高分子を、アミノ酸残基程度の大きさの「フラグメント」に分割して処理することによって、分子全体の電子状態を計算することのできる量子化学計算手法。高速かつ高精度にタンパク質などの量子化学計算を実施できるばかりでなく、フラグメント間の相互作用エネルギーを用いて分子間相互作用の定量的な議論が可能となる。
- Gタンパク質共役型受容体(GPCR)
7回膜貫通型の構造を特徴とする膜タンパク質ファミリー。医薬品の主要な標的であり、市販されている医薬品の多くがGPCRを標的としている。
