\ストレスで皮膚が若返る?!/ 超速老化魚を使って皮膚の若さを保つメカニズムを解明
小胞体ストレスが皮膚幹細胞を若い状態に戻す
研究成果のポイント
- 細胞がストレスを受けた時に働く防御機構と考えられてきた小胞体ストレスが、老化した皮膚幹細胞を若い状態に戻せることを発見
- 老化メカニズムはその研究に長大な時間を要するため、詳細な機構の理解はあまり進んでいなかったが、超速老化魚ターコイズキリフィッシュと、独自の可視化技術・網羅的解析技術を組み合わせ、短期間で皮膚老化メカニズムの解明に成功
- ヒトの皮膚老化に対する有望な治療・予防戦略の開発につながる可能性を期待
概要
大阪大学微生物病研究所の大学院生のDaniel Semmyさん(大学院生命機能研究科博士後期課程)、阿部耕太助教、石谷太教授らの研究グループは、九州大学や熊本大学などとの共同研究により、小胞体ストレスが皮膚幹・前駆細胞の若さ維持に寄与することを世界で初めて明らかにしました。
老化研究は、モデル動物であるマウスやゼブラフィッシュの寿命が約3年あり解析に年単位の時間がかかることや、細胞の分子レベルの変化を可視化し、かつ網羅的に解析できる技術が不足していることにより進展が遅れていました。今回、研究グループは、ヒトと同じ脊椎動物でありながら性成熟後2〜3ヶ月で老化して死に至る、超速老化魚ターコイズキリフィッシュ(略称キリフィッシュ)をモデルとして、独自に開発した可視化技術や遺伝子発現動態の網羅的解析技術を組み合わせることで、皮膚老化メカニズムの解析に挑みました。その結果、細胞にストレスを受けたときに働く防御機構としてよく知られる小胞体ストレス応答経路が、意外にも皮膚の表皮基底層で強く活性化して遺伝子発現を制御し、表皮幹細胞の「若さ」(増殖活性)を維持していることを見出しました。加えて、老齢の表皮に小胞体ストレスを与えると、表皮幹細胞の遺伝子発現が若い状態に戻り、増殖活性が復活することも発見しました。また、マウス組織解析やヒト公開データ解析の結果、キリフィッシュと同様に、ヒトやマウスの皮膚でもこの「小胞体ストレス応答-Vcp経路」による幹細胞制御と加齢に伴う機能低下が起きている可能性が強く示されました。
この成果は、ストレスに対する防御機構と考えられてきた小胞体ストレス応答経路が皮膚の若さを保つことを明らかにし、老化した皮膚幹細胞を若返らせる可能性のある新しい治療・予防戦略につながる有望な知見を示しました。
本研究成果は、英国科学誌「Aging Cell」に、10月12日(日)(日本時間)に公開されました。
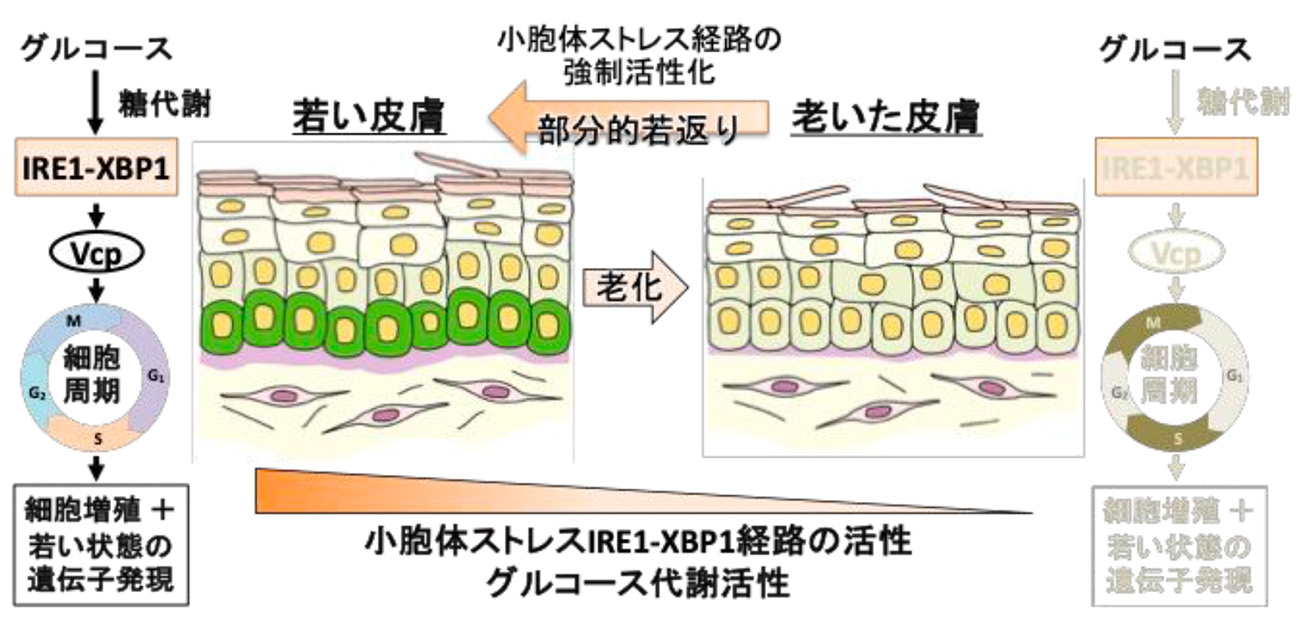
図1. 小胞体ストレスが若い皮膚を保つ
研究の背景
皮膚幹細胞の老化: 組織・臓器の恒常性は、幹細胞の活動によって支えられています。例えば、生体を損傷や感染から守る上皮である皮膚では、自己複製能力を持つ表皮幹細胞が基底層(表皮最下層)に位置し、継続的な皮膚組織の細胞の新陳代謝と創傷修復に重要な役割を果たしています。しかし、表皮幹細胞は加齢に伴って増殖能力を失い、結果として皮膚の恒常性や損傷修復能力が低下します。これまで、表皮幹細胞の増殖・分化機構や皮膚老化メカニズムは広く研究されてきましたが、加齢に伴う幹細胞の機能低下が、幹細胞内のどのような分子レベルの変化によって駆動されるのかについては、まだよくわかっていません。
小胞体ストレス応答と老化: 幹細胞の老化に加えて、老化のもう一つの大きな要因として、タンパク質恒常性(プロテオスタシス)の破綻が知られています。タンパク質恒常性とは、タンパク質合成を監視し、タンパク質の品質管理を確実にし、適応メカニズムを使用して折り畳まれていないタンパク質や誤って折り畳まれたタンパク質の蓄積を軽減することで、異常タンパク質の蓄積を防ぎ、組織の恒常性を維持するシステムです。タンパク質恒常性を担うシステムとしては、ユビキチン-プロテアソーム系とリソソーム-オートファジー系がよく知られており、これらは折り畳まれていないタンパク質を分解して細胞から除去します。これらのシステムは加齢とともに活性低下することが知られています。この二つに加えて、第三のシステムとして小胞体ストレス応答があります。小胞体は、細胞内の総タンパク質の約3分の1の合成と折り畳みを担っていますが、細胞への酸化ストレス、変異タンパク質の出現や低酸素状態などのストレス下では、誤って折り畳まれたタンパク質(変性タンパク質)が小胞体に過剰に蓄積した状態が誘導されます。この小胞体ストレスと呼ばれる状態が続くと小胞体の機能障害や細胞死を引き起こすため、これを回避するために小胞体ストレスが生じた細胞では「小胞体ストレス応答」が活性化します。小胞体ストレス応答はIRE1-XBP1経路、PERK-ATF4経路、ATF6経路という 3つの経路が担っており、変性タンパク質の蓄積を防ぎます。小胞体ストレスと老化の関係については、無脊椎動物である線虫において加齢に伴って小胞体ストレスに対する応答経路の応答能力が低下することなどが報告されていますが、脊椎動物における小胞体ストレス応答の加齢変化については、まだ十分に理解されていません。その理由の一つとして、よく使用される脊椎動物モデルであるマウスやゼブラフィッシュの寿命が約3年あり、解析に時間がかかりすぎることが挙げられます。つまり、時間の長さが研究のボトルネックとなっていました。
老化研究を加速する新たなモデル動物: 石谷教授の研究グループは、時間がかかりすぎる老化研究を加速するために、ヒトと同じく脊椎動物でありながら孵化後1ヶ月以内に性成熟し、その後2〜3ヶ月で老化して死に至る、超速成長超速老化魚であるターコイズキリフィッシュ(略称キリフィッシュ)に注目し、それを用いた老化研究系を立ち上げてきました。そして昨年には、キリフィッシュを用いて「メスの寿命をオスよりも長くする仕組み」と「ビタミンDで健康寿命を延ばせること」を明らかにしています(Abe et al., Science Advances 2024)。しかし、キリフィッシュは新しいモデル動物であるため、実験手法の整備が遅れています。例えば、近年、組織内の局所に存在する細胞の状態変化を分子レベルで網羅的に解析する手法として「空間トランスクリプトミクス」がありますが、現在この技術の多くは商用ベースで開発されているため、ヒトやマウスの代表的な組織(ユーザーが多く商売になるサンプル)に対してしか使用できません。キリフィッシュでマウスと同等の深度で研究を行うためには、キリフィッシュで空間トランスクリプトミクスを実現する必要があります。
研究の内容
キリフィッシュで小胞体ストレス応答を可視化: 研究グループは、小胞体ストレス応答の加齢変化を短期間で調べるために、短期間で老化するキリフィッシュをモデルに用いることにしました(図2上段)。具体的には、まず、3つの応答経路のうち無脊椎動物からヒトまで高度に保存されたIRE1-XBP1経路に注目し、この経路の活動を可視化したキリフィッシュを開発しました。この可視化キリフィッシュの解析などによって、肝臓、心臓、脳など多様な組織で、加齢に伴ってIRE1-XBP1経路が活性化することがわかってきました。実際、加齢した肝臓では小胞体ストレスの兆候である変性タンパク質の蓄積と小胞体の形状およびサイズの変化も観察されました。つまり、加齢による変性タンパク質の蓄積の結果として、肝臓などで慢性的な小胞体ストレスが発生することがわかってきました。この「加齢で慢性ストレスが起こる」という結果は、予想通りの結果でした。
小胞体ストレス応答は表皮幹細胞の増殖を促す: ところが、可視化解析を進める中で、予想外なことがわかってきました。それは、皮膚の幹細胞が存在する表皮基底層ではむしろ若い時期にIRE1-XBP1経路が活性化しており、加齢に伴って活性が低下するということです(図2下段)。興味深いことに、基底層の細胞では、変性タンパク質は検出されませんでした。この事実は、基底層でのIRE1-XBP1経路の強い活性化が、変性タンパク質の蓄積とは無関係である可能性を示しています。では、IRE1-XBP1経路は若い基底層で何をやっているのでしょうか?上述の通り、若い幹細胞は高い増殖活性を持っています。実際、若い表皮において、IRE1-XBP1活性の高い基底層細胞(幹細胞群)は高い増殖活性を持っていました(図3上段)。また、IRE1-XBP1活性が低下した、加齢した表皮では、増殖活性が失われていました(図3中段)。興味深いことに、小胞体ストレスを活性化する薬剤であるツニカマイシンを加齢した魚に投与したところ、表皮基底層における細胞増殖活性が復活しました(図3下段)。これらの結果は、表皮基底層における小胞体ストレス応答経路の活動が細胞増殖を促進することと、小胞体ストレスの強制活性化により老化した表皮の基底層の活動を若返らせる可能性があることを示しています。また、キリフィッシュにおいてIRE1遺伝子を破壊すると若い時期の表皮基底層細胞の増殖が低下することや、若いキリフィッシュから採取した培養表皮幹細胞にツニカマイシンを処理すると細胞増殖が活性化し、IRE1を阻害する薬剤を与えると増殖が低下することも確認しました。つまり、IRE1-XBP1経路が表皮幹細胞の若さ(増殖活性)に寄与することがわかってきました。
空間トランスクリプトミクスで小胞体ストレスによる若さ制御が見えてきた: では、小胞体ストレス経路は表皮基底層細胞の状態をどのように変化させているのでしょうか?これを調べるには表皮基底層細胞の遺伝子発現状態の加齢変化を解析する必要がありますが、表皮基底層という局所細胞について、ましてやキリフィッシュという特殊生物を対象として、そのような解析手法は存在しませんでした。しかし、幸いにも石谷教授が前々職の九州大学で同じキャンパス内で勤務していた同世代の研究仲間である大川恭行博士(現・九州大学生体防御医学研究科所長)や沖 真弥博士(現・熊本大学大学院医学研究科教授)の助力を得て、彼らが開発した最先端空間トランスクリプトミクス技術Photo-isolation chemistry(PIC)をキリフィッシュに利用する機会を得ることができました。PICは、興味がある細胞に光を照射することで組織をバラバラにすることなくトランスクリプトーム情報を取得することができ、従来技術に比べて安価かつどんな生物種にも利用可能であるという利点があります。我々は、キリフィッシュ表皮基底層細胞のPIC解析を行い、その結果、若い表皮基底層細胞と老齢の表皮基底層細胞では、遺伝子発現パターン(トランスクリプトーム)が明らかに異なっており、また、老齢の表皮基底層細胞にツニカマイシン(小胞体ストレス)を与えるとそのパターンが若返ることが確認できました(図4)。重要なことに、ツニカマイシン処理は、加齢に伴う小胞体ストレス応答や細胞増殖に関わる遺伝子発現の低下だけでなく、表皮幹細胞の分化制御に寄与するNotchシグナルやプレキシン-セマフォリンシグナルに関連する遺伝子発現の加齢変化もキャンセルしました。つまり、小胞体ストレスが、老化した表皮基底層のさまざまな活動を若返らせることが明らかになりました。
IRE1-XBP1はVcpを介して増殖を促進する: では、小胞体ストレス応答IRE1-XBP1経路は、どのようにして細胞増殖を促進するのでしょうか?我々は、PIC解析において若い時期に発現が高く、加齢で発現低下し、ツニカマイシン処理で発現が復活する遺伝子に注目し、それらの解析の結果として細胞周期進行を正に制御するVcpが、IRE1-XBP1経路の下流で発現誘導されて、表皮基底層細胞の増殖を促すことを見つけました(図1)。
グルコース代謝の低下がIRE1-XBP1の加齢による活性低下を導く: 続いて、加齢に伴ってIRE1-XBP1の活性が低下するメカニズムを調べました。まず、PIC解析と代謝物の測定により、表皮基底層において、加齢に伴ってグルコース代謝能力の低下が起きていることを見つけました。さらに、グルコースをキリフィッシュ培養表皮幹細胞に添加すると、IRE1-XBP1経路が活性化し、細胞増殖が促されることがわかってきました。つまり、加齢に伴うグルコース代謝の低下が、表皮基底層におけるIRE1-XBP1活性と細胞増殖の低下を導く可能性が示されました(図1)。
ヒトやマウスでも同様の制御が起こる: このように、研究グループは、キリフィッシュにおいて、グルコース代謝-IRE1-XBP1-Vcp経路が若い表皮基底層の幹細胞活性を維持しており、加齢に伴うグルコース代謝の低下がこの経路の活性低下と表皮幹細胞の機能低下を導くことを見つけました。では、哺乳類ではどうでしょうか?まず、東京大学医科学研究所と連携したマウス皮膚組織解析により、マウス基底層においてもIRE1-XBP1経路が若い時期に活性化しており、加齢に伴って活性低下することが確認できました。また、ヒト皮膚の公開トランスクリプトームデータを解析したところ、キリフィッシュ皮膚と同じように、ERストレス応答関連遺伝子、Vcp遺伝子、およびグルコース代謝関連遺伝子の発現が加齢依存的に低下することがわかってきました。さらに、ヒトの皮膚細胞(ケラチノサイト)においてもツニカマイシンで増殖を促進でき、IRE1-XBP1経路の抑制で増殖を抑制できることも確認しました。すなわち、キリフィッシュ皮膚と同じ幹細胞制御とその加齢に伴う機能低下が、ヒトやマウスの皮膚でも起きることが示唆されました。
図2. IRE1-XBP1経路は表皮幹細胞では加齢で活性低下する
図3. IRE1-XBP1経路は表皮幹細胞の増殖を支える
図4. 小胞体ストレスで遺伝子発現パターンが若返る
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、細胞がストレス状態の時に稼働する防御システムとしてよく知られている小胞体ストレス応答が皮膚の若さを保つ、という、これまで全く知られていなかった小胞体ストレス応答の新たな一面が明らかになりました。この制御は、皮膚に限らず他の組織幹細胞でも機能している可能性があり、本研究を起点に未知の普遍的な幹細胞老化制御機構が明らかになる可能性が期待できます。
また、本研究は「小胞体ストレスを与える」という、老化した皮膚幹細胞を若返らせる可能性のある新たなアプローチを明らかにしました。今後、ヒト表皮幹細胞における小胞体ストレス応答の役割と制御がより深く理解されることにより、本発見を起点とした、ヒト皮膚老化に対する新たな有望な治療・予防戦略の開発につながる可能性が期待されます。
また、今回の研究で見つけた新たな表皮細胞増殖促進因子であるVcpは、ヒト皮膚において男性では20代から40代にかけて発現が減少するものの40代以降は変化がなく、一方で女性では40代以降から徐々に減少します。興味深いことに、皮膚の老化は男性の方が早く起こるものの女性では閉経後に急速に老化が進むことが知られており、こうした老化の性差に関連する可能性も期待できます。現在、研究チームは、今回のように超短命魚とヒトデータを駆使して新たな老化機構や若さ維持機構を見つけるだけでなく、それらの性差や個人差の解析も進めており、将来的な「個人ごとの老化制御」を目指した研究を継続しています。乞うご期待ください。
特記事項
本研究成果は、2025年10月12日(日)(日本時間)に英国科学誌「Aging Cell」(オンライン)に掲載されました。
タイトル:“ER stress Ire1-Xbp1s pathway maintains youthful epidermal basal layer through the regulation of cell proliferation”
著者名:Daniel Semmy, Kota Abe, Mizuki Honda, Hiroko Omori, Shohei Ogamino, Tobias Clausen Mercurio, Kyosuke Asakawa, Emi K. Nishimura, Shinya Oki, Yasuyuki Ohkawa, and Tohru Ishitani
DOI:https://doi.org/10.1111/acel.70258
なお、本研究は、九州大学生体防御医学研究所や熊本大学大学院医学研究科、東京大学医科学研究所、広島大学大学院統合生命科学研究科との共同研究により行われ、また、AMED-CREST(24gm2010001h0001)、 AMED-BINDS (4512)、科学研究費補助金(21H05287, 24H02323, 24H02323, 22H02820, 23K18242, 24K21949, 20K15701, JPJSA3F20230001)、公益財団法人 中谷財団、公益財団法人武田科学振興財団研究助成、公益財団法人 セコム科学技術振興財団、公益財団法人コーセーコスメトロジー研究財団、大阪大学OUマスタープランなどの支援を受け、実施されました。
参考URL
微生物病研究所生体統御分野
https://ishitani-lab.biken.osaka-u.ac.jp
SDGsの目標
用語説明
- 小胞体ストレス
翻訳されたタンパク質が正常に機能するためには正しく折り畳まれる必要があるが、全てのタンパク質のうち35%が細胞小器官の一つである小胞体(Endoplasmic Reticulum:ER)で折り畳まれる。しかし、細胞への酸化ストレス、変異タンパク質の発現、低酸素状態などのストレス下では、小胞体でタンパク質の折り畳みが正常に行われず変性タンパク質が蓄積する。この状態を小胞体ストレスと呼ぶ。小胞体ストレスが続くと小胞体の機能障害や細胞死を引き起こすため、細胞はこれを回避するシステム「小胞体ストレス応答」を備えている。小胞体ストレス応答はIRE1-XBP1経路、PERK-ATF4経路、ATF6経路という 3つの経路が担っており、誤って折り畳まれたタンパク質の蓄積を防いでいる。
- ターコイズキリフィッシュ
アフリカの乾燥地帯に生息する体長4cm程度の小型の淡水魚で、寿命がわずか数ヶ月しかない超短命魚。この寿命の短さは研究室の飼育環境でも再現され、さらに、この短期間に神経変性や腫瘍形成など、ヒトとも共通する様々な老化形質を示すことから、非常に有用なモデル脊椎動物として近年注目を集めている。石谷研究室は、現在の老化研究のボトルネック(データサイエンスや細胞研究、無脊椎動物モデル研究で留まってしまって脊椎動物での検証、メカニズム解析が進んでいない)を解消し、老化研究を革新し、真に健康寿命延伸を目指す研究を行うためにキリフィッシュを使った研究系を7年かけて立ち上げてきた。
- 表皮基底層
皮膚は外側の「表皮」と、その下にある「真皮」から形成され、表皮の一番奥に位置する層を「表皮基底層」という。基底層には「表皮幹細胞」が存在し、常に新しい皮膚細胞を生み出して皮膚を入れ替えている。
- 表皮幹細胞
皮膚の表皮基底層に存在する特殊な細胞で、自己複製能(自分と同じ細胞を作る能力)と、多分化能(皮膚のさまざまな細胞に分化できる能力)を持つ。これにより皮膚の恒常的な入れ替えを可能にし、皮膚の恒常性や損傷修復力を維持している。表皮幹細胞は加齢とともに増殖力が低下し、これらの機能が低下する。

