胃カメラしながら 膵がんの早期発見
早期膵がん発見し検診に応用可能な診断法の開発
研究成果のポイント
- 胃カメラの際に通常の胃がん検診でも観察する十二指腸乳頭部を洗浄しその回収液を遺伝子検査することで「早期膵がん」を高精度に診断できることを明らかに
- これまで、膵がんの早期発見可能なスクリーニング法はなかったが、「胃がん検診の胃カメラ」の際に早期膵がんを発見可能に
- 膵がん克服において最も有益な早期発見・早期治療(手術)に貢献し、膵がん克服に向けた大きな一歩
概要
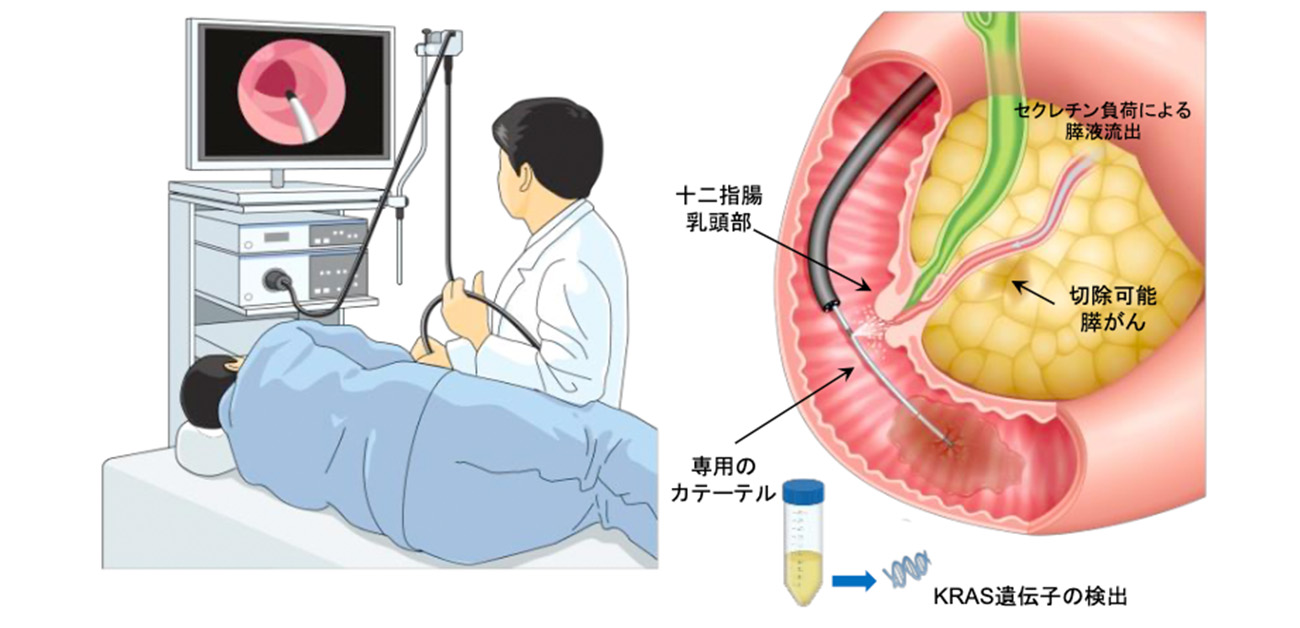
大阪大学大学院医学系研究科の谷内田真一 教授(がんゲノム情報学)らの研究グループは、胃カメラの際に追加検査として、十二指腸乳頭部を洗浄して回収液中のKRAS(ケーラス)遺伝子変異を検出する「リキッドバイオプシー(液性生検)」により、高い診断精度で早期膵がんを診断できることを明らかにしました(図1)。
膵がんには効果の高い抗がん剤が少ないことから、膵がん克服には早期発見・早期治療(根治手術)が最も重要です。しかしこれまでに膵がんを早期発見する高精度な検査法はありませんでした。
本検査により難治性がんである膵がん克服への道が開けるものと期待されます。
本研究成果は、米国外科学会誌「Annals of Surgery」に、2月4日オープンアクセスとして先行公開されました。
図1. 胃カメラしながら膵がん診断
膵液の分泌を促すセクレチンを投与し、膵管の出口である十二指腸乳頭部に 胃カメラを留置する。胃カメラを介して専用のカテーテルを挿入しカテーテルの側孔から生理食塩水 20mLで十二指腸乳頭部を洗浄する。十二指腸内に溜まった洗浄液をカテーテルの先端の6個の孔から回収する。回収液中のKRAS遺伝子変異を検出する。
研究の背景
膵がんは難治性がん(5年生存率:約13%)として知られ、日本でも患者数の増加が社会問題となっています。難治性の理由として、早期発見が難しいため診断時にすでに他の臓器やリンパ節に転移があり、手術適応とならないことが挙げられます。一方、膵がんを早期に発見し手術を行い、手術後に抗がん剤治療を行った患者さんの5年生存率は約53%となっています。つまり膵がんにおいて、早期発見・早期治療(手術)が最も有効な治療法です。
ほぼ全ての膵がんにおいて、最初の遺伝子異常はKRAS(ケーラス)遺伝子の変異です。したがって、全ての膵がん細胞はKRAS遺伝子変異を有しており、「KRAS遺伝子変異という最高のバイオマーカー」があることが、他のがんと異なります。しかし、このKRAS遺伝子変異は血液中(血液を用いたリキッドバイオプシー)には、全身に転移があるような膵がん患者さんでしか検出できず、別のアプローチからの検査法の開発が期待されていました。
これまでに研究グループは膵がんの自然史は約15年から20年と実は長いということを発見しており(Yachida S et al. Nature. 2010)、早期発見できるタイムフレームは十分にあることを踏まえて、有効な診断法の開発を試みました。
研究の内容
研究グループは全国の10施設と協力して、健康者(75人)と初診時手術適応膵がん患者さん(89人)を対象に、通常の胃カメラ検査の際に合成ヒトセクレチンを静脈投与し、十二指腸乳頭部を専用のカテーテルで洗浄し、それを回収しました。検査時間は通常の胃カメラ検査に1〜2分の追加でできる簡易で身体的に負担の少ない検査です。回収液からDNAを抽出し、PCR法でKRAS遺伝子の変異量を測定しました。
その結果、手術適応膵がん患者さん(手術した早期膵がんだった患者さん)と健康者(健常者として登録され検査の結果、膵臓に病気のなかった人)を比較すると、統計学的に有意にKRAS遺伝子変異が、手術適応膵がん患者さんに非常に多いことが分かりました(図2)。
図2. 十二指腸洗浄回収液中のKRAS遺伝子変異
KRAS遺伝子100,000個あたりの遺伝子変異数を示す。
(縦軸は対数(10倍ごと目盛)を示していることに注意)
図3. KRAS変異のROC曲線
健康者と早期膵がんを判別するROC(Receiver Operating Characteristic)曲線とその曲線下面積(Area Under the Curve: AUC)を示す。 AUCは0から1までの値をとり、値が1に近いほど二つの群の判別能が高いことを示す。
*は統計学的に適切なカットオフ値
これまでの膵がんの腫瘍マーカー(CEAやCA19-9)では手術適応膵がんを発見することは困難とされ、米国では膵がんのスクリーニング検査として推奨されていません。偽陽性があり、その場合は身体的な負担が大きい検査が必要となるためです。本研究でもCEA(図4)とCA19-9(図5)では偽陽性があり、感度や特異度は本検査を下回ることが明らかになりました。
図4. CEAのROC曲線
*は統計学的に適切なカットオフ値
図5. CA19-9のROC曲線
*は統計学的に適切なカットオフ値
図6. 専用のカテーテル
本研究成果が社会に与える影響(本研究成果の意義)
これまでに膵がんを早期診断可能なスクリーニング法はありませんでした。本検査は、腫瘍マーカー(CEAやCA19-9)のような間接的なバイオマーカーではなく、膵がん細胞由来の遺伝子変異をとらえる「直接的なバイオマーカー」で検出できます。
日本においては2年に1回の胃がん検診、特に胃カメラが推奨されています。その際に膵がんハイリスク者を対象に、スクリーニング検査として本検査を追加することで、膵がんの早期発見・早期治療が期待されます。本検査は膵がん克服に向けた大きな一歩といえます。
特記事項
本研究成果は、2025年2月4日に米国外科学会誌「Annals of Surgery」にオンライン版のみ、先行公開されました。
タイトル:“KRAS mutations in duodenal lavage fluid after secretin stimulation for detection of pancreatic cancer”
著者名:Shinichi Yachida1,2(責任著者), Shigetaka Yoshinaga3, Satoshi Shiba4, Makiko Urabe5, Hidenori Tanaka1, Yohei Takeda6, Akinori Shimizu7, Yuri Sakamoto6, Susumu Hijioka8, Shin Haba9, Reiko Ashida10, Yoshinori Kushiyama11, Kento Asano12, Makiko Kobayashi12, Yoshiyuki Murawaki13, Kouji Onishi14, Taro Yamashita6, Hirokazu Kimura1, Totoki Yasushi1, Hideki Kamada15, Hajime Isomoto6, Satoshi Hattori2,16, Chigusa Morizane8, Kazuyoshi Ohkawa5, Masayuki Kitano10, Kazuo Hara9, Kenji Ikezawa5, Keiji Hanada7, Kazuya Matsumoto6
所属:
1. 大阪大学 大学院医学系研究科 ゲノム生物学講座 がんゲノム情報学
2. 大阪大学先導的研究機構(OTRI)
3. 国立がん研究センター中央病院 内視鏡科
4. 国立がん研究センター研究所 がんゲノミクス研究分野
5. 大阪国際がんセンター 肝胆膵内科
6. 鳥取大学医学部統合内科医学講座 消化器腎臓内科学分野
7. JA尾道総合病院 消化器内科
8. 国立がん研究センター中央病院 肝胆膵内科
9. 愛知県がんセンター 消化器内科部
10. 和歌山県立医科大学 消化器内科(内科学第二講座)
11. 松江赤十字病院 消化器内科部(松江市膵がんプロジェクト)
12. 大阪大学医学部附属病院 未来医療開発部 臨床研究センター
13. 松江市立病院 消化器内科(松江市膵がんプロジェクト)
14. 松江生協病院 消化器内科(松江市膵がんプロジェクト)
15. 香川大学医学部 内科学講座 消化器・神経内科学
16. 大阪大学 大学院医学系研究科 情報統合医学講座 医学統計学
DOI: https://doi.org/10.1097/sla.0000000000006645
本研究は、AMED革新的がん医療実用化研究事業(JP17ck0106274h、JP20ck0106546h、JP24ck0106808h)、国立がん研究センター研究開発費(2022-A-05)、公益財団法人武田科学振興財団、公益財団法人安田記念医学財団、公益財団法人三菱財団、公益財団法人高松宮妃癌研究基金の一環として行われ、シスメックス株式会社とSBカワスミ株式会社の協力を得て行われました。
参考URL
用語説明
- 十二指腸乳頭部
別名Vater(ファーター)乳頭とも呼ばれる。乳頭部とは十二指腸の中心付近に位置し、肝臓で作られる「胆汁」の通り道である「胆管」と、膵臓で作られる「膵液」の通り道である「膵管」が合流し十二指腸に開口する場所である。Vater(ファーター)とは、発見したドイツ人解剖学者Abraham Vater(アブラハム・ファーター)(1684年-1751年)から名付けられた。
- 5年生存率:約13%
出典:国立がん研究センター「院内がん登録2014-2015年生存率集計」5年ネット・サバイバル
- 膵がんの自然史
膵がんは「末梢(目に見えないレベルの)膵管細胞由来」とされている。末梢膵管細胞にKRAS遺伝子に変異が入ることで「前がん病変」ができ、さらにCDKN2AやTP53遺伝子の異常が蓄積され膵がんとなる。谷内田教授らは、膵管細胞分裂速度と遺伝子変異の数などから、膵がんにおいては、最初にKRAS変異が入ってから肉眼的に観察され、転移をきたすまでのタイムラインは「約15〜20年」と見積り、2010年にNature誌に報告した(Yachida S et al. Nature. 2010, 467:1114, Campbell PJ, Yachida S et al. Nature. 2010, 467:1109)。この二つの論文は、これまでに計4,600以上の雑誌に引用されている。
- 合成ヒトセクレチン
セクレチン(Secretin)は小腸粘膜で合成され、膵臓から重炭酸、水分、電解質などを含む「膵液」の分泌を大量に亢進させる消化管ホルモンである。27個のアミノ酸からなるペプチドホルモンであり、そのうち14個はグルカゴンと同じである。セクレチンを投与することで末梢膵管から主膵管を経由して膵がん由来細胞やDNAが十二指腸乳頭部への流出を促進する。
ブタ由来セクレチン(セクレパン®、エーザイ株式会社:当時は約250円)は50年以上前からセクレチン負荷試験として静脈投与され、慢性膵炎やガストリノーマの診断に使用され、その有用性は確立されていた。しかし、BSE(Bovine Spongiform Encephalopathy、いわゆる狂牛病)問題をきっかけに生物由来製品が敬遠されるようになり、ほとんどの国でブタセクレチンが使われなくなり、日本でもセクレパン®が2004年に製造・販売を中止した。
米国では直ちに合成ヒトセクレチン(ChiRhoStim®)が製造され、2004年にFDA(アメリカ食品医薬品局:日本の厚生労働省に似た役割)の承認を受け、10万人以上に使用されている。合成ヒトセクレチンのクリアランスは580.9 ± 51.3 mL/分、分布容積は2.7 Lである。
日本膵臓学会は厚生労働省に要望書を提出し、「医療上の必要性の高い未承認薬・適応外薬検討会議」で医療上の必要性が高いと評価を得て、厚生労働省は開発企業の募集(又は企業に開発要請)を現在も行っている。
本研究は臨床研究法のもと合成ヒトセクレチン(ChiRhoStim®)を米国ChiRhoChin社から輸入し、本邦未承認薬であることから臨床研究法のもと「特定臨床研究」として実施した。
すなわち日本においてドラッグラグ・ロスの状態が2004年から続いており、大きな社会問題となっている。一方、同じ消化管ホルモンであるグルカゴンについては、動物膵由来グルカゴン製剤からグルカゴンGノボ(遺伝子組換え、ノボ ノルディスク ファーマ株式会社、2,427円)が製造販売され、日本において健康保険で使用できる薬となっている。
- 専用のカテーテル
通常使用されている造影などに使われるカテーテルは先端に孔が1個だけのために、十二指腸乳頭部の洗浄と回収を同時にすることは出来ない。さらに吸引の際に先端の圧が高く、十二指腸粘膜を吸着してしまい、十分な回収量が得られなかった(図6A)。
専用のカテーテルは二層になっており、図6Bの上層で十二指腸乳頭部を生理食塩水で洗浄する(水色)。カテーテルの先端から30mmのところに黒色でマーキングされた部位に側孔がある。胃カメラに専用のカテーテルを挿入し、先端を進めて黒色に部位(側孔があるところ)を十二指腸乳頭部を留置する。側孔から生理食塩水で十二指腸乳頭部を洗浄する(水色)。
下層は洗浄液を吸引するために設計されており、先端に6つの孔があり、圧を分散させて効率よく洗浄液を回収できる(オレンジ色)。
SBカワスミ株式会社と共同で開発し、既に製造販売承認を受けている。特許出願中である。
- 特異度
検査で病気(本研究の場合は膵がん)を有さない人のうち、検査が正しく陰性と判断した人の割合。膵がんのスクリーニング検査としては「特異度」が最も重要とされる。検査で膵がんを有さない人が、検査で陽性と判断された場合は、身体的負担の大きい検査(ERCP(Endoscopic retrograde cholangiopancreatography)など)が必要となったり、「膵がんかもしれない」という精神的な負担が生じたりするためである。
- 感度
病気(本研究の場合は膵がん)を有する人において、検査で正しく陽性と判断した割合。
- AUC
ROC(Receiver Operating Characteristic)曲線は、診断法がどのくらい有用なのかを解析する統計学的な方法で、特定のカットオフ値を設定したときの感度・特異度をそれぞれ縦軸・横軸(1-特異度)にプロットし、折れ線で結んだ曲線になる。曲線下の面積(AUC:Area Under the Curve)によって定量化される。0から1の間の値を取り、1に近いほど陽性率と疑陽性(以下、参照)率をバランスできている、すなわち精度が良いことを示す。0.9以上が非常に良い検査とされ、0.8以上が良い検査とされる。
- 偽陽性
実際には病気(本研究の場合は膵がん)ではないのに、検査結果が陽性に出ること。
- 膵がんハイリスク者
膵がん家族歴、遺伝性膵がん症候群、遺伝性膵炎、糖尿病の新規発症/増悪、腫瘍マーカーの上昇、膵嚢胞、膵管異常、膵酵素異常などが膵がんのハイリスクとされている。
