胃がんの新しい腫瘍マーカーを発見
血液から非侵襲・高感度にメチル化DNAを検出
研究成果のポイント
- 胃がんにおいて、非侵襲的かつ高感度な新しい腫瘍マーカーを発見
- 血中循環腫瘍DNA(ctDNA)として、SPG20、FBN1、SDC2、TFPI2、SEPT9の5遺伝子のメチル化DNAを、胃がん患者の末梢血から高感度に検出することに成功
- これら5遺伝子のメチル化レベルを測定することで、胃がんの早期発見、病勢モニタリング、予後予測などに利用できる可能性が示された。
概要
大阪大学大学院医学系研究科消化器外科学 黒川幸典 准教授、永野慎之介さん(大学院生)、土岐祐一郎 教授らの研究グループは、胃がん患者の血液から高感度に特定のDNA(メチル化DNA)を検出する方法を発見しました。この方法では、5つの遺伝子のDNAのメチル化の程度(メチル化レベル)を測定することで、胃がんにおける新たな腫瘍マーカーになり得ることを発見しました。
胃がんはわが国における3大がんの1つですが、これまで特定の腫瘍マーカーがありませんでした。胃がんの早期発見ならびに治療のためには、非侵襲的かつ高感度な腫瘍マーカーの開発が喫緊の課題と言われていました。
研究グループは、血液検査でがん細胞やその由来物質を解析する「リキッドバイオプシー」という技術を使い、新たな腫瘍マーカーの開発に取り組みました。その結果、血中循環腫瘍DNA(circulating tumor DNA: ctDNA)として、SPG20、FBN1、SDC2、TFPI2、SEPT9の5遺伝子のメチル化DNAを、胃がん患者の血液から高感度に検出することに成功しました。これらのメチル化レベルを測定することで胃がんの早期発見、病勢モニタリング、予後予測などに利用できる可能性が示されました。
本研究成果は国際科学誌「Scientific Reports」誌に2024年12月28日にオンラインで掲載されました。
研究の背景
わが国における罹患率および死亡率の高い3大がんの1つとして胃がんが挙げられます。その検査法として、現在では内視鏡検査やCT検査などが使用されていますが、内視鏡検査は患者にとって侵襲的で苦痛を伴う検査であり、CT検査は放射線被曝ならびに胃がんに対する低い検出率(感度)が問題となります。血液を利用した腫瘍マーカー検査は低侵襲で簡便ですが、前立腺がんに対するPSAのような胃がん特異的な腫瘍マーカーはありません。現在はあくまでも転移再発の補助診断として、様々ながん腫で汎用されているCEAやCA19-9などを利用していますが、これらの検出感度は切除不能なStage Ⅳの進行胃がんであっても50%以下に過ぎません。そのため、もっと検出感度が高く、的確に体内の腫瘍量を評価できるような非侵襲的な腫瘍マーカーの開発が求められていました。
そうした中、分子生物学的テクノロジーの進歩により、がん細胞の遺伝子変異の情報を元に、患者の末梢血中を循環している微量ながん細胞のDNA(ctDNA)を検出することが徐々に可能になってきました。このctDNAは、非侵襲的かつ簡便に測定可能な腫瘍マーカーとして利用可能とされ、近年世界中で注目されています。研究グループでは、これまでにも胃がんや食道がん、消化管間質腫瘍(GIST)において、末梢血中からctDNAを検出することに成功してきました。しかし、胃がんはその分子生物学的特性から、大腸がんや肺がんなどと比べてctDNAの検出感度が低いことが明らかとなっています。臨床の現場で用いるためには、さらなる改良を行ってctDNAの検出感度を上げる必要があります。
研究の内容
研究グループは、ctDNAを検出する新たな方法として、従来のようにがん細胞の遺伝子変異の情報ではなく、後天的な遺伝子発現調節機構の一つであるDNAのメチル化に着目しました。DNAのメチル化はこれまで、発がんや腫瘍進行のメカニズムに関与していることが分かっており、ほとんどのがん腫で早期の段階から高頻度に過剰なメチル化が生じています。この過剰なメチル化DNAをctDNAとして末梢血中で検出することで、胃がんの早期発見、病勢モニタリング、予後予測などに利用できるのではないかと考え、本研究を開始しました。
胃がんに対して高感度にメチル化DNAを検出できる遺伝子を同定するため、これまで他がん腫においてメチル化との関連性が報告されている63遺伝子の中から、The Cancer Genome Atlas (TCGA)のデータベースを用いて胃がんでメチル化レベルの高い遺伝子を調べたところ、44遺伝子が選択されました。さらに、当院の胃がん切除検体のがん部と非がん部10例ずつより抽出したDNAのメチル化レベルを次世代シークエンサー(NGS)で解析したところ、この44遺伝子の中でもSPG20、FBN1、SDC2、TFPI2、SEPT9の5遺伝子が、胃のがん部でのメチル化が特に亢進していることが判明しました(図1)。
図1. 胃のがん部と非がん部における44遺伝子のDNAメチル化レベル
そこで当院で化学療法を施行中だった再発胃がん患者16人の末梢血を用いて、この5遺伝子のDNAメチル化レベルをNGSで解析し、メチル化がより亢進していた患者(高メチル化群)とそれ以外の患者(低メチル化群)との間で全生存期間を比較すると、メチル化高値群は有意に予後不良であることが確認されました(図2)。
図2. 特定5遺伝子の末梢血中DNAメチル化レベルと予後の関係
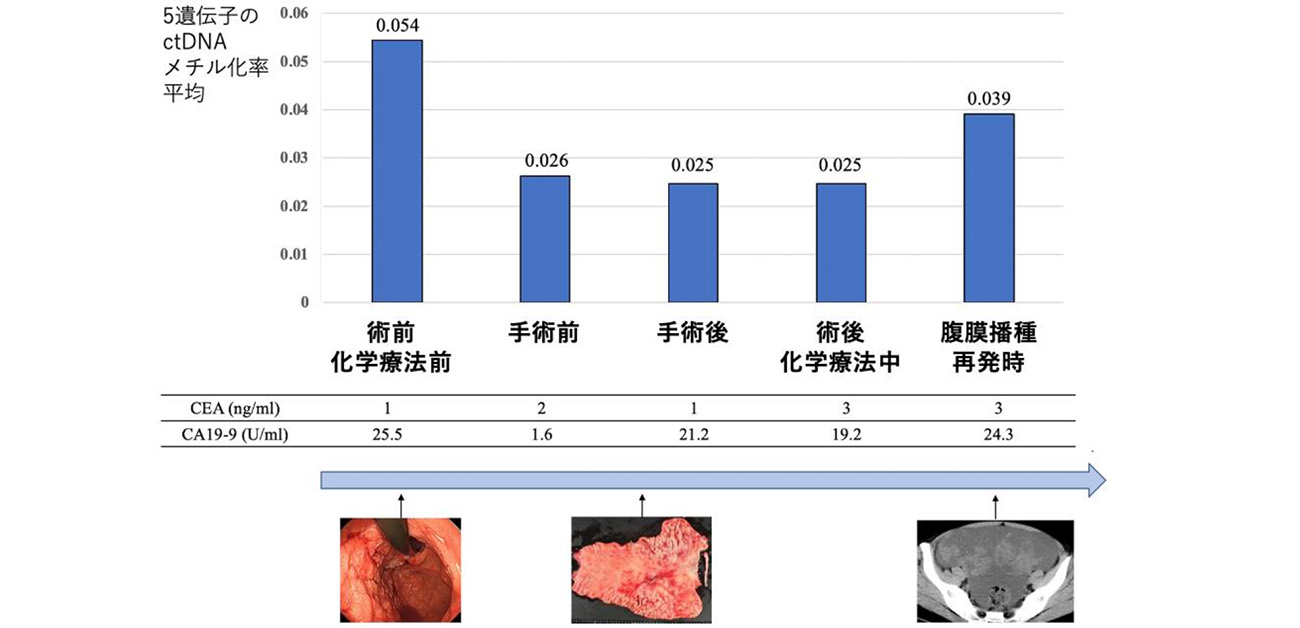
また、複数のタイミングで採血を行った症例に対しては、上記5遺伝子のDNAメチル化レベルの経時的推移を検討しました。この患者はステージⅢの胃がんと診断され、術前に化学療法を施行する前に採取した末梢血中のDNAメチル化レベルは高値でした。しかし、術前化学療法終了後の手術前には半分以下にまで低下し、手術実施後や術後の補助化学療法を行っている間もDNAメチル化レベルは低値を維持していました。しかし、その後DNAメチル化レベルは再上昇し、同時に腹膜に再発を来たしましたが、この時点での2つの腫瘍マーカーCEAとCA19-9は正常値のままでした(図3)。このように、研究グループが発見した5遺伝子のDNAメチル化レベルは、従来の腫瘍マーカーよりも的確に体内の腫瘍量を反映しており、胃がんの早期発見、病勢モニタリング、予後予測などに利用できる可能性が示されました。
図3. 特定5遺伝子の末梢血中DNAメチル化レベルと胃がん病勢の関係
今後の展望
本研究により、SPG20、FBN1、SDC2、TFPI2、SEPT9の5遺伝子の末梢血中DNAメチル化レベルは、体内の腫瘍量を的確に反映する新たな腫瘍マーカーとして利用できる可能性が示されました。
この研究成果は現在特許申請中であり、この5遺伝子の末梢血中DNAメチル化レベルを、デジタルPCRを用いてより簡便かつ安価に測定できる手法を開発中です。
特記事項
【論文情報】
掲載誌: Scientific Reports
タイトル: “Extensive methylation analysis of circulating tumor DNA in plasma of patients with gastric cancer”
著者名: Shinnosuke Nagano, Yukinori Kurokawa*, Takaomi Hagi, Ryo Yoshioka, Tsuyoshi Takahashi, Takuro Saito, Kazuyoshi Yamamoto, Kota Momose, Kotaro Yamashita, Koji Tanaka, Tomoki Makino, Kiyokazu Nakajima, Hidetoshi Eguchi, Yuichiro Doki
(*責任著者)
DOI: https://doi.org/10.1038/s41598-024-79252-y
本研究は、科学研究費助成事業(JP23K08169)の助成を受けたものです。
用語説明
- 血中循環腫瘍DNA(ctDNA)
circulating tumor DNA。血中循環腫瘍DNAは、がん細胞のDNAが細胞死などにより血液中に漏れ出したもので、短く断片化されやがて体外に排出されます。がん細胞がもつDNAの異常を血液で調べることができるため、がん診断への利用が期待されています。
- DNAのメチル化
DNAメチル化は、DNAを構成する4つの塩基(A、T、G、C)のうち、シトシン(C)の5位の炭素にメチル基(CH3)が付加される化学修飾です。遺伝子配列は変えずに、後天的に遺伝子の働きを調節する機構の代表的なものです。遺伝子の転写開始部位の周囲でメチル化頻度が高くなると、遺伝子発現が抑制されます。がんを抑制する遺伝子にメチル化が起こることで、その遺伝子発現が抑制され、発がんや腫瘍進行のメカニズムに関与していると報告されています。
- 次世代シークエンサー(NGS)
DNAやRNAの塩基配列を高速かつ大量に解読する装置や技術です。生命科学や医学の分野で広く利用されており、個の医療や遺伝性疾患、臨床診断学などの分野に大きな変革をもたらしています。
- デジタルPCR
デジタルPCRはサンプル中に含まれる個々の分子の数をカウントして定量を行う新しい技術です。従来のPCR法に比べ正常サンプル中に0.01%程度のレベルでわずかに含まれる希少な分子を同定・定量することが可能な高感度な手法です。
