細菌の忌避行動と細胞内情報伝達系の 同時計測に成功
「生体分子の振る舞いが生物の行動を生み出す」原理の解明へ
研究成果のポイント
- 大腸菌の忌避行動と情報伝達系を担うタンパク質の細胞内動態を、同一の細胞で同時に計測することに成功し、両者の関係を定量化した。
- これまで細胞の行動と細胞内タンパク質の動態は別々に計測されており、両者の相関関係は同じ細胞で計測されていなかった。
- 『生体分子の振る舞いが生物の行動を生み出す原理』を知る重要な手掛かりとなり、生命に普遍的な情報伝達システムの分子レベルでの理解につながると期待。
概要
大阪大学大学院生命機能研究科の福岡創准教授、石島秋彦教授らの研究チームは、大腸菌の忌避応答と情報伝達系を担うタンパク質を同一の細胞で同時に観察することに成功しました。
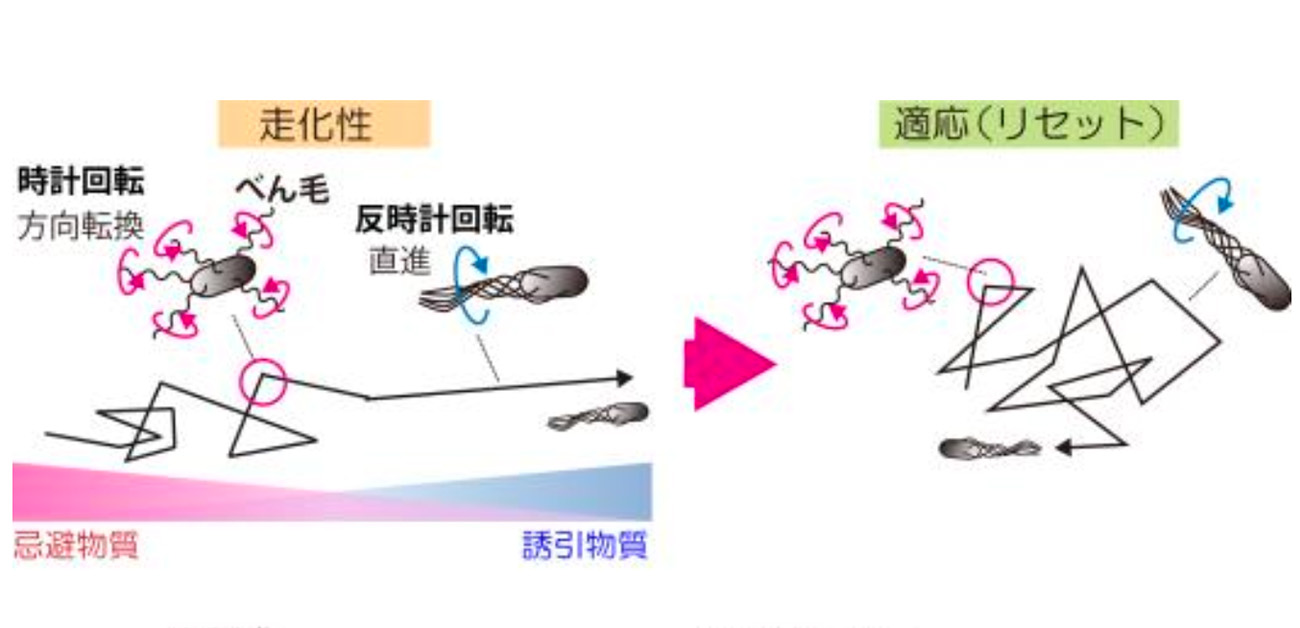
大腸菌は1000分の1ミリメートル程度の単細胞生物でありながら、走化性システムと呼ばれる情報伝達系でべん毛モーターの回転をコントロールし、より良い環境へ移動します(図1)。これを細胞の忌避行動と呼びます。忌避行動を起こすきっかけとなる細胞外の刺激は、細胞膜内の受容体で認識後、べん毛モーターに伝えられ、細胞の運動がコントロールされます。また走化性システムは、一度反応した刺激に反応しなくなるようにシステムをリセット(適応)しており、受容体のメチル化レベルで調節されています。細胞の走化性システムに関わるこれらの酵素について、実際に刺激に対して応答している細胞の中で、どのような動態を示すのかについては不明でした。
今回、研究チームは、受容体脱メチル化酵素とメチル化酵素をGFPで蛍光標識し、忌避刺激に対する細胞の応答(べん毛モーターの回転)と両酵素の動態を同時に観察しました(図2)。その結果、脱メチル化酵素の局在が非常に動的であり、さらに局在が受容体クラスターの活性の強さを反映していることを発見し、忌避応答時の細胞の行動と、脱メチル化酵素の細胞内動態とを関連づけることができました(図3)。本成果は『細胞内の生体分子の振る舞いが細胞(あるいは生物の)行動を生み出す根源的な原理』を知る重要な手掛かりになり、生命に普遍的な情報伝達システムの分子レベルでの理解につながると期待されます。
本研究成果は、米国科学誌「Science Advances」に、9月21日(土)3時(日本時間)に公開されました。
図1. 大腸菌の走化性と走化性システムの情報伝達経路
図2. 忌避刺激に対する細胞応答と受容体脱メチル化酵素動態の同時計測。
(A)計測する細胞系。(B)結果の例。上段はGFP融合した受容体脱メチル化酵素を発現する細胞の蛍光像。下段は上段で示した細胞の解析結果。赤は細胞極の明るさ、青は細胞質の明るさ、緑はべん毛モーターの回転方向のそれぞれの時間変化を示す。
図3. 受容体クラスター活性と受容体脱メチル化酵素の局在のモデル。
忌避物質により受容体クラスターが活性化すると、(1)ヒスチジンキナーゼがリン酸化、(2–3)リン酸化状態のヒスチジンキナーゼに受容体脱メチル化酵素が結合しリン酸基を受け取り、(4)受容体を脱メチル化する。(5)脱メチル化が進行すると受容体クラスターの活性が刺激前の状態に戻り、適応が完了し、受容体脱メチル化酵素はヒスチジンキナーゼに結合できなくなる。
研究の背景
大腸菌は小さな単細胞生物でありながら、走化性システムと呼ばれる情報伝達システムを使い、高等生物のように環境をモニターし、べん毛モーターの回転をコントロールしてより良い環境へ移動します(図1)。
細胞外の刺激は細胞膜内の受容体で認識されます。忌避刺激を受容すると、受容体はヒスチジンキナーゼを活性化し、細胞外の情報がヒスチジンキナーゼのリン酸化レベルとして細胞内の情報に変換されます。リン酸基は応答調節因子に転移されモーターの回転方向を制御します。リン酸基は受容体脱メチル化酵素にも転移され、これにより受容体の脱メチル化を促します。受容体の脱メチル化が進行すると、受容体はヒスチジンキナーゼの活性を忌避刺激前の状態にし、忌避刺激を打ち消します。この現象は適応とよばれます。逆に受容体メチル化酵素は脱メチル化酵素と拮抗して誘因刺激を打ち消します。受容体はヒスチジンキナーゼなどの走化性関連タンパク質と共に、数万分子からなる巨大な受容体クラスターを形成しています。
これまで、受容体メチル化酵素や脱メチル化酵素がこの走化性受容体クラスターに局在することが知られていました。しかし、細胞が刺激に応答する時に、その細胞内でこれらの酵素がどのような動態を示すのかについては不明でした。
研究の内容
本研究では、受容体脱メチル化酵素、メチル化酵素について、それぞれのGFP融合タンパク質を用いて、生きた1つの細胞内でこれらの酵素を観察できるようにしました。同時に、べん毛に付着させた微小なビーズを介して、これらの酵素の細胞内動態と共にべん毛モーターの回転(細胞の応答)を同時に観察しました(図2A)。
その結果、忌避刺激による受容体クラスターの活性化に伴って、受容体脱メチル化酵素が受容体クラスターへ局在し、適応による受容体クラスター活性化の低下によって局在が減少することを初めて発見しました(図2B)。さらに詳細な解析により、1)受容体脱メチル化酵素の局在量が受容体クラスターの活性の強さを反映すること、2)脱メチル化酵素の受容体クラスターへの結合数、3)細胞の忌避応答と適応と受容体脱メチル化酵素の受容体クラスターへの結合・解離のプロセス、がわかってきました。一方で4)メチル化酵素は、受容体クラスターの活性に関わらず安定して局在する、ことがわかりました。
以上のように、忌避刺激に対する細胞の行動と、その行動を制御する細胞内タンパク質の動態を、定量されたデータを基に関連づけることができました(図3)。
本研究成果が社会に与える影響(本研究成果の意義)
本研究は、外環境刺激に対する細菌の細胞内のタンパク質の動態と細胞行動の変化を同じ細胞で計測しており、細胞の中で行われている情報伝達の一端を、タンパク質の動態として理解することができるようになりました。これは『細胞内の生体分子の振る舞いが生物の行動を生み出す原理』を知る重要な手掛かりになります。大腸菌の走化性システムは真核生物の情報伝達システムにも共通する部分があるため、今後の研究によって生命に普遍的に存在する情報処理システムを考察する上でも重要な知見をもたらすと期待されます。
特記事項
本研究成果は、2024年9月21日(土)3時(日本時間)に米国科学誌「Science Advances」(オンライン)に掲載されました。
タイトル:“CheB localizes to polar receptor arrays during repellent adaptation”
著者名:Hajime Fukuoka, Keisuke Nishitani, Taiga Deguchi, Taketo Oshima, Yumiko Uchida, Tatsuki Hamamoto, Yong-Suk Che, Akihiko Ishijima
DOI:10.1126/sciadv.adp5636
本研究は、日本学術振興会(JSPS)科学研究費補助金JP19H05797(研究代表者:石島秋彦)、JP21K06097(研究代表者:福岡創)による支援を受けて行われました。
参考URL
SDGsの目標
用語説明
- 忌避行動
大腸菌が、嫌いな化学物質や環境から逃避する行動。走化性システムにより制御される。
- 走化性システム
大腸菌が環境中の化学物質の濃度勾配に従って運動する走化性を示す。走化性システムはこの性質を制御する細胞内情報伝達系。細胞は誘因物質へ集まり、忌避物質には近づかない。
- べん毛モーター
大腸菌などの細菌の運動器官。細胞膜に埋まった基部体(回転モーター)、べん毛繊維(スクリュー)、両者を繋ぐフック(ユニバーサルジョイント)で構成される。タンパク質で作られた回転装置で、大腸菌のモーターは水素イオンをエネルギーとして回転する。
- 適応
一度反応した刺激に対して反応しなくなるようにシステムをリセットする機能。「適応」により大腸菌は広い範囲の濃度差を感知できる。
- GFP
Green Fluorescent Protein。緑色蛍光タンパク質。緑色の蛍光を発するタンパク質としてオワンクラゲから発見された。観察したいタンパク質に融合させることで、細胞内で働くタンパク質を光らせて観察することができる。
- 受容体クラスター
受容体およびヒスチジンキナーゼなどの走化性システムを構成するタンパク質は、細胞の極で数万分子から成る巨大クラスターを作る。

