軽量・安全な固体水素キャリアから低電位で水素生成
ホウ化水素シートを用いた水素貯蔵・放出技術
研究成果のポイント
- ホウ化水素シートから常温・常圧条件・電気エネルギーのみで水素を放出
- ギ酸などの水素源と比べ、より低電位で水素を放出
- 軽量・安全な水素貯蔵・放出材料としての応用に期待
概要
東京工業大学 物質理工学院 材料系の河村哲志修士課程2年、山口晃助教、宮内雅浩教授、大阪大学 大学院工学研究科の濱田幾太郎准教授、筑波大学 数理物質系の近藤剛弘教授らの研究グループは、二次元ナノ材料であるホウ化水素シートから、常温・常圧において電気エネルギーのみで水素を放出できることを見出した。
ホウ化水素シートはホウ素と水素の組成比が1:1のナノシートで、近年日本で発明された物質である。ホウ化水素シートは軽元素のホウ素と水素からなり、その質量水素密度は8.5 wt%と極めて高く、爆発のリスクのある水素ガスボンベに代わる軽量で安全な水素キャリアとしての応用が期待されている。これまでホウ化水素シートから水素を放出させる手段として、加熱や強い紫外線の照射が報告されていたが、今回、電位を印加するのみで水素を放出できることを見出した。水やギ酸などの他の水素源と比較して、ホウ化水素シートは水素を放出するために必要な電気エネルギーが小さく、より低電位で水素を放出できることを実証した。
本研究で開発した手法においては、ホウ化水素シートの分散体に電位を印加する単純な操作で、常温・常圧という穏やかな条件で水素を取り出すことができた。これを応用することで爆発性のある水素の貯蔵と放出を、高温や高圧を要する従来の方法よりも低エネルギーで安全に達成することが期待できる。
本研究成果は2024年2月1日付の科学誌「Small」に掲載された。
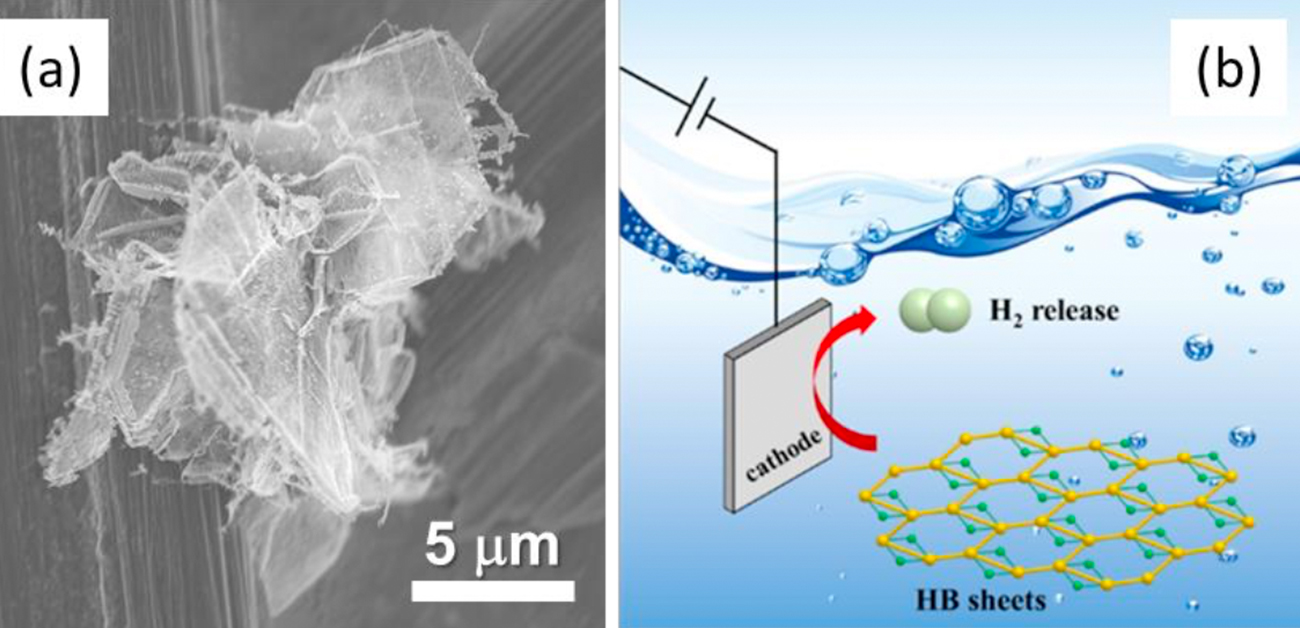
図1. ホウ化水素シートの走査型電子顕微鏡写真(a)と、陰極(cathode)への電位の印加によってホウ化水素シート(HB sheets)の分散体から水素分子(H2)が放出される様子を示す模式図(b)
研究の背景
脱炭素化の一環でもある水素エネルギーの普及のため、水素を安全に貯蔵・運搬、そして、低エネルギーで放出できる水素キャリアが求められている。水素キャリアとしてよく使われる高圧水素ガスボンベは、水素貯蔵密度が低く、爆発や火災のリスクがあった。一方、液体の水素キャリアとしてアンモニア、ギ酸、有機ハイドライド等が知られるが、毒性、腐食性、水素放出に高温の加熱工程が必要などの課題があった。また、固体の水素キャリアとして水素吸蔵合金等が知られるが、それらの質量水素密度は低く、軽量で貯蔵・運搬するには大きな課題があった。
一方、筑波大学の近藤剛弘教授の研究グループは、水素貯蔵密度が高い固体状の二次元物質であるホウ化水素シートの合成に成功した(東工大プレスリリース 2017年9月26日)。ホウ化水素シートの質量水素密度は8.5 wt%を誇り、水素貯蔵密度の高い有機ハイドライドとして知られるメチルシクロヘキサンの値6.2 wt%を大きく上回る。これまで、ホウ化水素シートから水素を放出させる手段として加熱工程が知られているほか、紫外線の照射でも水素を放出できることを当研究グループが報告している(東工大プレスリリース 2019年10月25日)。しかしながら、加熱工程は化石燃料の使用を余儀なくされ、紫外線照射は光の当たる部分のみからしか水素が放出せず、効率的な水素生成に大きな課題があった。
今回の研究においては、ホウ化水素シートの分散体に電位を印加する単純な操作で、常温・常圧という穏やかな条件で水素を取り出すことができた。
研究成果
ホウ化水素シートは正に帯電した水素と負に帯電したホウ素から構成されている。我々の既報(Nat. Commun. 10, 4880, 2019)における第一原理計算から、ホウ化水素シートにおける水素の反結合性軌道に外部電極から電子を注入することで水素を放出できることを予想した。
既報(J. Am. Chem. Soc. 139, 13761, 2017)と同様にイオン交換法でホウ化水素シートを合成し、合成した粉末をアセトニトリル溶媒に分散させた。その分散溶液に電解質も溶解させた後に、カーボン製の作用極と対極、およびAg/Ag+からなる参照極を挿入し、電気化学的な水素生成特性を評価した。電位を印加しない自然電位の条件では水素生成は認められなかった一方、電位を負に印加することでホウ化水素シート分散体からは水素が生成した。作用極に-1.0 V(対Ag/Ag+電極)の電位を印加した際の水素生成量は図2(a)に示した通りである。各電位における電流密度と水素生成速度を図2(b)に示す。ホウ化水素シート分散体においては、水素生成速度と電流密度が同様の傾向を示したことから、電流密度の増加は水素生成由来と理解できる。このときの水素生成のファラデー効率は90%以上の高い値を示し、作用極からホウ化水素シートに電子注入することで水素が生成していることが示唆された。また、作用極に-1.0 V(対Ag/Ag+電極)の電位を48時間印加することで、ホウ化水素シート自身が持っている水素量をほぼ全量放出できることも確認した。
図2. 電位(-1.0 V vs. Ag/Ag+)を印加した場合の水素生成量 (a), 各電位における電流密度と水素生成速度 (b).
観測された水素分子の生成がホウ化水素シート自身に含まれる水素原子由来であることを確認するため、同位体を用いた追跡実験も行った。すなわち、ホウ化水素シートの水素原子を重水素原子に置換した試料を用いて同様の電気化学反応を行い、生成するガスを質量分析で解析した。その結果、質量数が3や4の重水素分子が生成することが確認できた。これらの実験結果からも、外部電極からホウ化水素シートに電子が注入される機構で水素が放出されることが明らかになった。
次に、ホウ化水素シートから水素を放出させるために必要な電気エネルギーについて、他の水素源である水やギ酸と同一の電気化学反応条件で比較した。図3に、各種水素源に対して電位を-1.0 V(対Ag/Ag+電極)に設定した場合の水素生成速度とオンセット電位を示す。その結果、ホウ化水素シートは同じ電位の条件でも水分子やギ酸より水素生成速度が速く、オンセット電位も低かった。すなわち、ホウ化水素シートはギ酸などの他の水素キャリアと比べ、より大量の水素を低エネルギーで放出することが示された。水素生成特性は溶媒中の水素イオン濃度と関連すると考えられたが、ホウ化水素シートの酸解離定数(pKa)は3.5 ± 0.2であって、ギ酸のpKa= 3.25とほぼ同様の値である(Commun. Mater. 2, 81, 2021)。これらの結果から、ホウ化水素シートにおける優れた水素放出性能は単純に溶液中の水素イオン濃度では説明できず、その特異な二次元構造が水素生成に有利であったことを示唆している。
図3. 各種水素源の水素生成速度(at -1.0 V vs. Ag/Ag+)とオンセット電位(at -0.01 mA/cm2).
水素放出後のホウ化水素シートの構造解析を行った結果、二次元のナノシート状の形状は維持され、負に帯電したホウ素種も確認できた。これらの結果は、水素放出後のホウ化水素シートに水素イオン源を添加することで、持続的に水素が生成する可能性を示唆している。
今後の展開
ホウ化水素シートが軽量・安全、そして、常温・常圧条件下でも低エネルギーで水素放出が可能な水素キャリア材料であることが分かった。今回はホウ化水素シートの分散体に対して評価を行ったが、本研究成果は分散体のシステムに限定されるものではなく、膜構造体や基板への担持体等にも適用できる汎用的な技術と成り得る。今後、ホウ化水素シートの大量合成、製造プロセスの低コスト化、膜構造体の開発を進め、更に、繰り返し使用可能な持続的水素生成システムの構築に向けた研究開発を行う予定である。
特記事項
【論文情報】
掲載誌:Small
論文タイトル:Electrolytic Hydrogen Release from Hydrogen Boride Sheets
著者:Satoshi Kawamura, Akira Yamaguchi*, Keisuke Miyazaki, Shin-ichi Ito, Norinobu Watanabe, Ikutaro Hamada, Takahiro Kondo*, Masahiro Miyauchi*
DOI:10.1002/smll.202310239
本研究の一部は、新エネルギー・産業技術総合開発機構(NEDO)の委託業務JPNP14021 により行われた。
用語説明
- ナノシート
厚さがナノメートルオーダーの二次元状の物質の総称。代表的なナノシートとして、炭素からなるグラフェンが知られる。
- 水素キャリア
水素を貯蔵・輸送するための担体。高圧水素ガスボンベ、液化水素、アンモニア、ギ酸、有機ハイドライド、水素吸蔵合金などが知られる。
- 第一原理計算
実験データや経験パラメーターを使わない基本的な原理に基づく計算。
- 反結合性軌道
分子同士の結合を開裂させるように働く軌道。
- 参照極
電気化学測定で電位の基準となる電極。本研究の電解液溶媒はアセトニトリルであるため、有機溶媒中でも使用できるAg/Ag+からなる参照極を用いた。
- ファラデー効率
電気化学反応で測定された電流に対し、実際の反応物生成に寄与した電流の割合。本研究では、水素1分子を生成するのに2電子を要するとして算出した。
- 同位体
原子番号が等しく質量数が異なる物質。本研究では、水素原子の同位体となる重水素原子を用いて実験を行った。
- オンセット電位
電気化学反応が始まる電位。本研究では、電流値が-0.01 mA/cm2以上に達するときの電位とした。
- 酸解離定数(pKa)
酸の強さを定量的に表す指標。酸から水素イオンが放出される解離反応を考え、その平衡定数Kaの負の常用対数pKaによって表す。pKaが小さいほど強い酸となる。
