ACIDES:スクリーニング解析アルゴリズムの技術革新
ゲノム創薬や遺伝子治療ベクター開発を助ける新技術
研究成果のポイント
- 高分散な確率モデルをタンパク質スクリーニング実験の数理モデルと組み合わせた、タンパク質スクリーニング実験を解析するアルゴリズム(ACIDES)を開発
- これまでの手法では難しかった実験の統計誤差の評価や各タンパク質のスコアの正確な把握といった課題を解決
- ACIDESが様々な遺伝子治療法の開発や個別化医療に不可欠なゲノム創薬などの医療分野を飛躍的に前進させる可能性に期待
概要
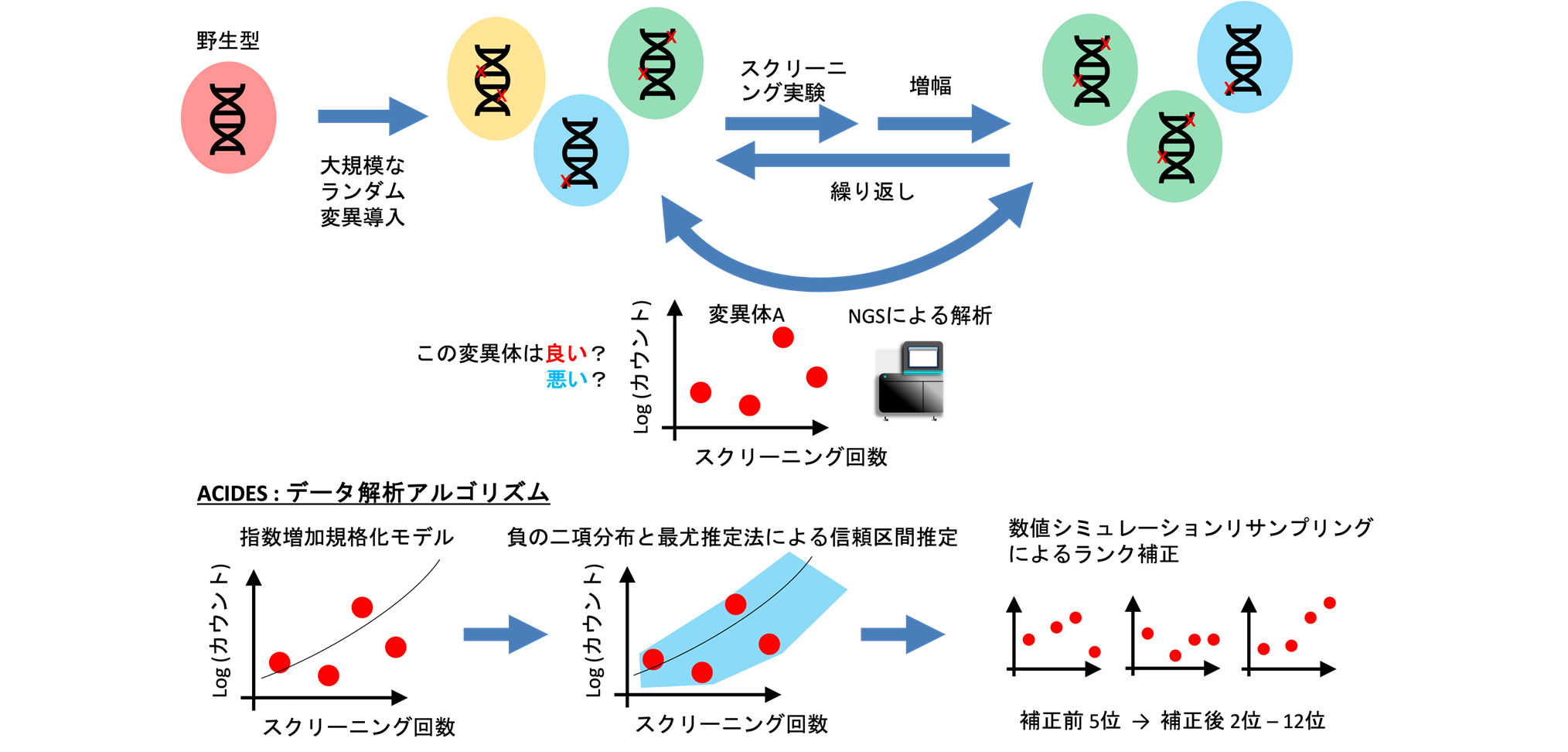
大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)の根本孝裕特任准教授(常勤)らの研究グループは、タンパク質スクリーニング実験を解析するアルゴリズム(ACIDES)を開発しました(図)。
タンパク質スクリーニングはタンパク質の創出や機能調査で使われる実験手法の一つで、創薬や病気のメカニズム解明など、医療分野の実験において頻繁に使用されています。精度の高いスクリーニングを行うためには実験結果をより正確に解析できる必要がありますが、次世代シーケンシング(NGS)を組み合わせた際の統計誤差の評価はまだ理解が進んでいませんでした。
今回、研究グループは、フランスのInstitut de la Visionの研究グループと共同で、高分散なNGSノイズを記述する統計モデルとタンパク質スクリーニングの数理モデルを組み合わせることにより、今までにない精度でタンパク質スクリーニング実験の統計誤差決定を可能にしました。遺伝子治療法で使われるウイルスベクターの開発や、個別化医療ゲノム創薬など、今後様々な応用が期待されます。
本研究成果は、米国科学誌「Nature Communications」に、12月26日(火)19時(日本時間)に公開されました。
図. タンパク質スクリーニング実験と解析アルゴリズム:ACIDES
研究の背景
タンパク質スクリーニングとは、ランダムな遺伝的変異を与えたタンパク質をふるい分ける手法で、遺伝的変異によってタンパク質が受けた影響を調べたり、また新しいタンパク質を設計したりするのに使われます。SARS-CoV-2受容体結合領域を調べるのにも使われたDeep Mutational Scanning法や、2018年度のノーベル化学賞の対象にもなったタンパク質設計手法である指向性進化法(Directed Evolution)も、タンパク質スクリーニングの応用の一つです。特に、数百万ものDNA配列を同時に決定できる次世代シーケンシング(NGS)と併用することで、スクリーニング中のタンパク質に対して大量のデータを得て、機械学習を応用する研究が最近注目され始めています。しかし、次世代シーケンシングによる統計的な誤差は一般的に大きく、それがタンパク質スクリーニングに対して与える影響はよく知られていませんでした。
研究の内容
本研究は、フランスのInstitute de la VisionのDeniz Dalkara、Ulisse Ferrariらと共同で、次世代シーケンシングによる統計誤差がタンパク質スクリーニング実験においてどのように伝搬されるかを研究しました。PCR増幅などによって増倍される高分散なNGSノイズは負の二項分布によって統計的に記述できることが知られていましたが、その統計モデルを、タンパク質スクリーニング実験の数理モデルと最尤推定法を使って組み合わせました。既存の複数のアルゴリズムと系統的に比較したところ、今までにない精度でタンパク質スクリーニング実験の評価が出来ることが明らかになりました。提唱したアルゴリズムは、ACIDES(Accurate Confidence Intervals for Directed Evolution Scores)の名の下、一般に公開されています。
本研究成果が社会に与える影響(本研究成果の意義)
ACIDESを応用することで、指向性進化法の実験パイプラインをより正確に設計し、遺伝子治療法の分野を前進させるウイルスベクターの開発につながることが期待されます。共同研究グループのInstitute de la Visionでは、内境界膜を通過するのに最適化されたアデノ随伴ウイルス変異体(AAV7m8)を開発した実績も持ちます。タンパク質スクリーニングを使う指向性進化法を用いてアデノ随伴ウイルスを改良する研究は盛んに行われていることからも、今後ACIDESが遺伝子治療の開発に大きな役割を果たすかもしれません。
また、大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)では、ヒトオルガノイドなどから得られるデータを活用した個別化医療の実現を目指しています。近年、Deep Mutational ScanningなどのNGSを用いたタンパク質スクリーニングが、個別化医療やゲノム創薬でもますます注目を集めています。ヒトの細胞やオルガノイドを用いた研究により得られた実験結果をACIDESと組み合わせることで、疾患に関わるタンパク質のスクリーニングへの活用などが見込まれており、将来の個別化医療実現に向けて展開されることが期待されます。
特記事項
本研究成果は、2023年12月26日(火)19時(日本時間)に米国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル: “ACIDES: on-line monitoring of forward genetic screens for protein engineering”
著者名: Takahiro Nemoto, Tommaso Ocari, Arthur Planul, Muge Tekinsoy, Emilia A. Zin, Deniz Dalkara and Ulisse Ferrari
DOI: https://doi.org/10.1038/s41467-023-43967-9
参考URL
根本孝裕特任准教授(常勤) 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/dace6e309fc0e18b.html
SDGsの目標
用語説明
- 次世代シーケンシング(NGS)
核酸(DNAとRNA)の塩基配列を読み取るシーケンシングで、次世代型は塩基配列を短時間で大量に並列処理することができる。これにより、解析のスピードが向上し、大きなゲノム領域を扱った研究ができるようになった。
- Deep Mutational Scanning
深層変異スキャンのこと。次世代シーケンシング技術などを活用し、大量の変異体を同時に解析できる技術。この技術により、タンパク質の構造と機能の関連性を理解することが飛躍的に進み、タンパク質エンジニアリングや創薬の分野で大きな進展が生まれた。
- 指向性進化法(Directed Evolution)
自然界の淘汰モデルを模して、研究者がタンパク質・核酸などの機能を目的に応じて向上させていく実験的手法。2018年度に、フランシス・アーノルドがノーベル化学賞を受賞した。

