がん免疫療法の効く・効かないは「糖鎖」が鍵!?
がん細胞死を促進する新たな糖鎖構造と制御機構を解明
研究成果のポイント
- がん細胞上の脂質に付加された特定の糖鎖(ルイス糖鎖)が、TRAILというサイトカインによるがん細胞死を亢進させることを初めて明らかにしました。
- がん細胞上または血中のルイス糖鎖の量を測定することで、TRAIL受容体を標的としたがん治療薬の治療効果を予測できる可能性を示しました。
- TRAIL受容体は、がん治療の分子標的として期待され、多くの治療薬が開発されていますが、TRAIL耐性を有するがん細胞等が理由で十分な治療効果のでない患者もあり、まだ臨床応用に至っていません。
- TRAILは腫瘍免疫監視機構の一翼を担うサイトカインであり、本研究によってがん免疫療法の治療効果の予測にもつながることが期待されます。
概要
大阪大学大学院医学系研究科生体病態情報科学講座の三善英知教授と東邦大学医学部生化学講座の森脇健太准教授らのグループは、腫瘍免疫監視機構の一翼を担う分子であるTRAIL (Tumor necrosis factor-related apoptosis-inducing ligand)によるがん細胞死を制御する糖鎖構造を発見し、その糖鎖構造が、TRAIL受容体が関わるがん治療の効果を予測する因子となり得ることを示しました。これにより、TRAIL受容体分子標的治療やがん免疫療法の治療効果を予測する手法の開発につながることが期待されます。
この研究は、がん細胞表面の糖脂質に付加されるルイス糖鎖という糖鎖構造が、TRAIL誘導性細胞死を促進させることを明らかとし、ルイス糖鎖の量を測定することでがん細胞のTRAIL誘導性細胞死への感受性を予測できる可能性を示した初めての研究です。これにより、TRAIL受容体分子標的薬、またさらにがん免疫療法の治療効果の予測とその予測に基づいた新たながん治療戦略の開発につながることが期待されます。
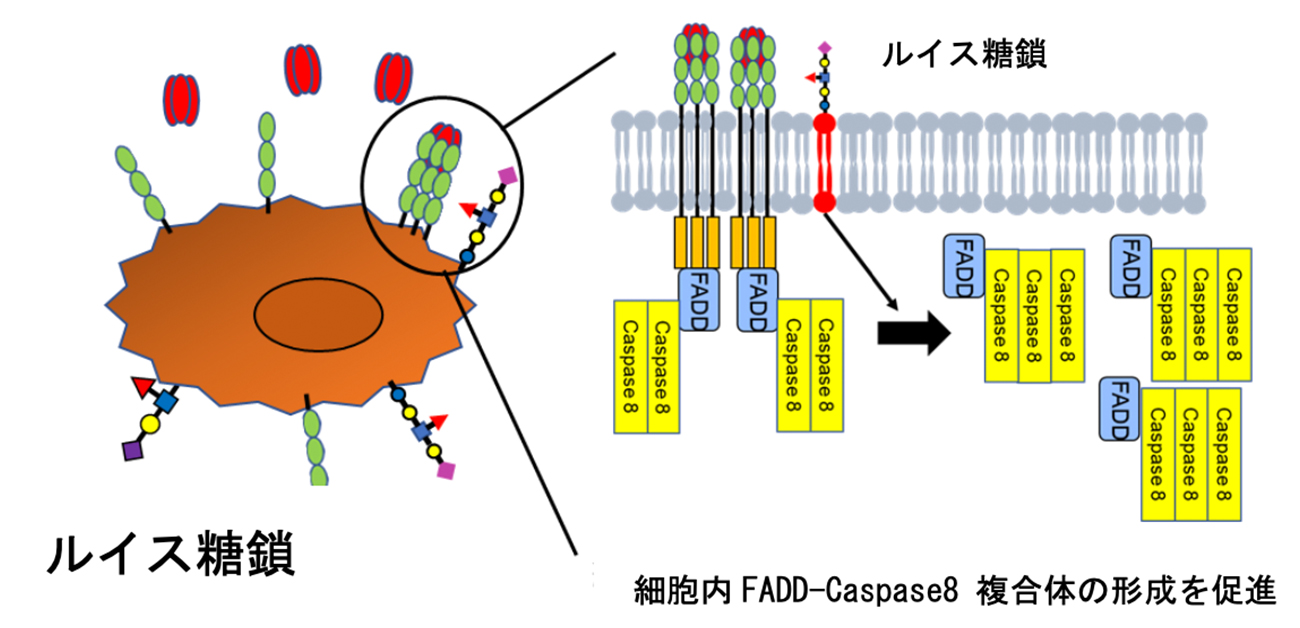
図1. ルイス糖脂質はTRAILによるがん細胞死を亢進させる
研究の背景
私たちの体の中では毎日数百~数千個もがん細胞が発生しています。がん化した細胞を白血球が監視し、排除する体内の仕組みとして、腫瘍免疫監視機構が存在します。今回研究グループが注目したTRAILは、細胞傷害性リンパ球に発現して、TRAIL受容体を発現するがん細胞に細胞死を誘導することでその増殖を抑制する働きがあり、腫瘍免疫監視機構の一翼を担います。TRAILはマウスを用いた実験などにより、正常組織には傷害を与えず、がん細胞に特異的に細胞死を引き起こす性質を有することが分かっています。そのため、TRAIL受容体はがん治療の分子標的として期待され、多くの製薬会社がTRAIL受容体分子標的薬の開発を進めています。これまでに様々な種類のがんに対して臨床試験が実施されましたが、TRAIL耐性を有するがん細胞の存在などの理由により十分な治療効果が見られない患者もおり、未だ臨床応用には至っていません。そのため、TRAIL誘導性細胞死のメカニズムや治療効果を予測する因子の解明などが必要となっています。一方、糖鎖は、細胞によってその構造が異なることから、がん細胞と正常細胞を見分ける指標(腫瘍マーカー)としても広く臨床応用されています。研究グループはこれまでにフコシル化という糖鎖修飾がTRAIL誘導性細胞死を制御することを明らかとしてきましたが、その詳細は分かっていませんでした。
研究の成果
フコシル化糖鎖は、フコースの結合の仕方でいくつかの種類に分けられます。どのフコシル化糖鎖がTRAIL誘導性細胞死を亢進させるかを調べたところ、がん細胞にルイス糖鎖というフコシル化糖鎖構造が存在するとTRAIL誘導性細胞死が亢進することが分かりました。ルイス糖鎖は糖タンパク質、糖脂質のどちらにも付加される糖鎖です。どちらに付加されるルイス糖鎖が重要かを調べたところ、糖脂質に付加されるルイス糖鎖がTRAIL誘導性細胞死を制御することが分かりました。より詳細な解析の結果、ルイス糖鎖が付加された糖脂質が細胞表面上に多く存在すると、細胞死を引き起こすタンパク質複合体(FADD-caspase 8複合体)の形成が促進されることがわかりました。
さらに、複数のヒト大腸がん細胞株や、大腸がん患者のがん組織から樹立したがんオルガノイドを用いて、がん細胞表面上のルイス糖鎖の発現量とTRAIL誘導性細胞死への感受性を調べたところ、ルイス糖鎖の発現量が多いがん細胞ではTRAIL誘導性細胞死への感受性が高いことが分かりました。このことから、がん細胞のルイス糖鎖の発現量はTRAIL受容体分子標的薬の治療効果を予測する因子となり得ることが示されました。
本研究成果が社会に与える影響(本研究成果の意義)
ルイス糖鎖は細胞のがん化によって増加することから、古くから腫瘍マーカーとして利用されており、特に有名な腫瘍マーカーであるCA19-9もルイス糖鎖に含まれます。CA19-9の測定、または糖脂質上のルイス糖鎖を特異的に認識する抗体の樹立とその利用によって、開発中のTRAIL受容体分子標的薬の治療効果の予測とその予測に基づいた新たながん治療戦略の開発が可能となることが期待されます。また、TRAILはCAR-T療法などのがん免疫療法の治療効果を規定する因子であるということも分かっています。そのため、今回の発見は、新たながん免疫療法の治療効果予測法や治療戦略の開発につながることが期待されます。
特記事項
本研究成果は、2022年8月15日に雑誌「Oncogene」にて発表されました。
タイトル:Lewis glycosphingolipids as critical determinants of TRAIL sensitivity in cancer cells
著者名:Tomoya Fukuoka, Kenta Moriwaki*, Shinji Takamatsu, Jumpei Kondo, Miki Tanaka-Okamoto, Azusa Tomioka, Manami Semba, Sachiko Komazawa-Sakon, Yoshihiro Kamada, Hiroyuki Kaji, Yasuhide Miyamoto, Masahiro Inoue, Kazuhiko Bessho, Yoko Miyoshi, Keiichi Ozono, Hiroyasu Nakano, Eiji Miyoshi* (*責任著者)
DOI:https://doi.org/10.1038/s41388-022-02434-3
なお、本研究は、大阪大学大学院医学系研究科 大薗恵一 教授、京都大学 井上正宏 特定教授、大阪国際がんセンター研究所 宮本泰豪 部長、産業技術総合研究所 梶裕之 上級主任研究員らとの共同研究によるものです。
参考URL
SDGsの目標
用語説明
- 糖鎖
糖が鎖のようにつながった生体分子で、核酸・タンパク質に次ぐ第3の生命鎖とも呼ばれている。タンパク質や脂質に付加されることで、それらタンパク質や脂質の様々な機能を制御している。
- サイトカイン
細胞から分泌されるタンパク質であり、細胞間相互作用に関与する生理活性物質の総称。標的細胞にシグナルを伝達し、多様な細胞応答を引き起こすことが知られている。
- 腫瘍免疫監視機構
がん化した細胞を白血球が監視し、排除する体内の仕組み。TRAILは細胞傷害性リンパ球に発現し、がん細胞に細胞死を誘導することでがんの進展を抑制する。
- がん免疫療法
体内に備わっている免疫力を増強することによって、がん細胞の増殖を抑える治療法。免疫チェックポイント阻害薬やCAR-T療法、がんワクチン療法などがある。
- フコシル化
糖鎖修飾の一種であり、糖鎖にフコースという単糖が付加されること。がんや炎症と深い関係を持つことが知られている。
- caspase 8
細胞死実行に関与するタンパク質分解酵素。TRAILにより刺激された細胞内では、初めにcaspase 8が活性化され、その後活性化caspase 8が特定のアミノ酸配列を有するタンパク質を切断することで細胞死を誘導する。
- がんオルガノイド
実際のヒトがん組織から作られたがん細胞の集団。がん組織の特性を保ちながら試験管内で増殖する三次元構造体であり、がん研究に応用されている。




