細胞膜の中ではたらく特殊なタンパク質分解酵素の 構造を解明
細菌感染症の新たな治療法の開発へ期待
研究成果のポイント
- 細胞膜の中ではたらく特殊なタンパク質分解酵素(RseP)と阻害剤の複合体構造を解明した。
- RsePが基質となる膜タンパク質を取り込むためのゲートをもつ可能性が示された。
- RsePがタンパク質を膜内部で切断する機構の解明にくわえ、細菌感染症治療法の開発などへの貢献も期待される。
概要
横浜市立大学大学院生命医科学研究科の禾 晃和准教授と京都大学医生物学研究所の秋山 芳展教授、檜作 洋平助教のグループは、東京大学大学院理学系研究科、理化学研究所、大阪大学蛋白質研究所、筑波大学生存ダイナミクス研究センター、東北大学医学系研究科との共同研究で、細胞膜の中ではたらく特殊なタンパク質分解酵素RsePと阻害剤の複合体構造を明らかにしました。
今回の研究により、RsePが基質となるタンパク質を切断する仕組みの理解が深まっただけでなく、RsePが基質を取り込むためのゲートを持つ可能性が示されました。今後、立体構造に基づいてこのゲートの働きを詳しく調べていくことで、RsePを特異的に阻害することが可能になり、細菌感染症などの新たな治療法の開発にもつながることが期待されます。
本研究成果は、「Science Advances」に掲載されます。(日本時間2022年8月25日(木)午前3時)
研究の背景
細胞膜に存在するタンパク質の機能の制御や分解・除去を行う仕組みの一つに「膜内タンパク質切断」があります。この膜内タンパク質切断は、細胞膜の中ではたらく特殊なタンパク質分解酵素(膜内切断プロテアーゼ)によって行われています。膜内切断プロテアーゼは、ヒトなどの高等生物からバクテリアまでさまざまな生物に存在し、コレステロールの代謝をはじめとして生命の維持に必要な現象に数多く関わっています。膜内切断プロテアーゼのうち、大腸菌に存在するRsePは、ストレスに対する応答や鉄の代謝を制御するシグナルを伝える役割に加えて、膜に蓄積する不要なペプチドを除去する役割を担っており、大腸菌の生育に必須なタンパク質です。RsePについては、長年、その機能を調べる研究が行われてきましたが、立体構造が明らかになっていなかったため、細胞膜の内部で基質となる膜タンパク質を切断する詳しい仕組みは分かっていませんでした。
研究の内容
RsePは変性しやすく精製が困難なタンパク質であるため、長年構造解析が進んでいませんでしたが、本研究では、独自に開発した抗体アフィニティー精製システム(PAタグシステム)を利用することで、高純度で切断活性を保ったRsePを精製することに成功しました。そして、基質と類似した構造をもち、阻害剤としてはたらくことが報告されていた化合物Batimastatを添加することで良質の結晶を作りました。また、本研究では、海洋性細菌Kangiella koreensis由来のRsePのホモログタンパク質(KkRseP)についてもBatimastatを添加して結晶を作り、これら2つのタンパク質の立体構造をX線結晶解析によって決定しました。RsePやKkRsePの結晶は、膜タンパク質特有の微小結晶であったことから、大型放射光施設SPring-8の理研ターゲットタンパクビームラインBL32XUを利用して高精度なX線回折データを取得しました。
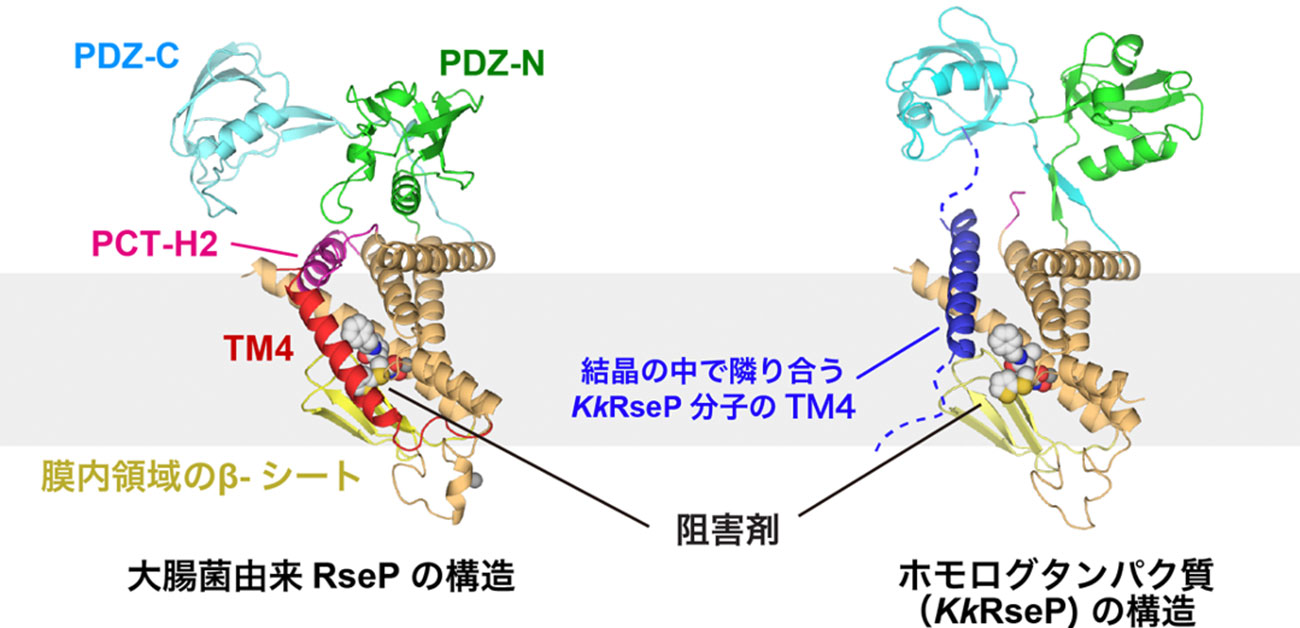
今回の構造解析では、RsePやKkRsePの全体構造が明らかになっただけでなく、基質となる膜タンパク質がRsePにどのように結合するのかについても重要な手がかりが得られました。ペプチドと類似した化合物であるBatimastatは、引き伸ばされた状態でRsePの膜内領域にあるβ-シートと相互作用していました。また、RsePやホモログタンパク質が共通してもっているアスパラギン残基(大腸菌RsePでは394番目のアスパラギン残基)がBatimastatを留め金のように固定していることも分かりました。このアスパラギン残基を変異させることで基質の切断効率が大きく低下したことから、基質となる膜タンパク質もRsePのβ-シートによって引き伸ばされ、アスパラギン残基によって固定された状態で切断される可能性が高いことが分かりました。
さらに、RsePとKkRsePの構造を比較したところ、RsePは基質を取り込む際にダイナミックに構造が変化する可能性があることも分かりました。RsePでは、ペリプラズム側の膜外ドメイン(PDZ-NとPDZ-C)、膜表面に存在するα-ヘリックス(PCT-H2)、そして、4本目の膜貫通ヘリックス(TM4)が、膜内部に位置する活性中心を覆い隠すような配置をとっていました。その一方で、KkRsePでは、PDZ-N、CドメインやPCT-H2、TM4の配置が大きく変化し、活性中心が露出していました。興味深いことに、結晶内で隣り合う別のKkRseP分子のTM4が、基質のように振る舞って、活性中心の近くに入り込んでいることも分かりました。
本研究では、これらの構造情報に基づいて、化学修飾実験を系統的に行い、PCT-H2やPDZ-N、Cドメインに可動性があることを確かめました。さらに、RsePの分子内に架橋を導入してPDZ-NやPCT-H2の配置を固定すると、基質の切断効率が低下することも明らかにしました。これらの結果は、PDZ-N、CドメインやPCT-H2、TM4が、基質を活性中心に取り込むために開閉し、ゲートとして働く可能性が高いことを示しています。また、PCT-H2の変異によって基質の取り込みに異常が起きたRseP変異体の中には、PDZ-Cドメインの配置が変化するものがあることも電子顕微鏡解析から示されました。この結果は、ゲートを構成するドメイン同士の相互作用によって基質の取り込みが制御されることを支持するものです。さらに、このゲートが開閉する際には、PCT-H2とTM4が446番目のアスパラギン酸残基を介して静電的に相互作用して一緒に動くことも推定されました。実際に、このアスパラギン酸残基の変異により活性が大きく低下することも示され、PCT-H2とTM4の相互作用が重要であることが確かめられました。
アルツハイマー病やがんに関わる膜内切断プロテアーゼであるγ-セクレターゼにも、ゲートを介して基質となる膜タンパク質を取り込む仕組みや膜の中で基質を引き伸ばして固定する仕組みがあることが分かっています。今回のRsePやKkRsePと阻害剤の複合体の構造解析によって、アミノ酸配列や切断反応の触媒機構が異なるRsePとγ-セクレターゼが、非常によく似た仕組みで基質の取り込みや切断を制御していることが示されました。
(図)大腸菌由来RsePと海洋性細菌由来のホモログタンパク質(KkRseP)のX線結晶構造解析から推定される基質の取り込みと切断のモデル。
RsePとKkRsePの構造では、PDZ-N、Cドメイン、PCT-H2、TM4の配置が大きく異なり、KkRsePでは結晶の中で隣り合う別のKkRseP分子のTM4が、活性中心の近くに入り込んでいる。RsePが基質となる膜タンパク質を活性中心へと取り込む際にも、PDZ-N、CドメインやPCT-H2、TM4をゲートのように開閉すると考えられる。また、このゲートの開閉の際には、TM4とPCT-H2を繋ぐアスパラギン酸残基(D)が重要な役割を担うと考えられる。亜鉛イオン(Zn)が結合する活性中心に取り込まれた基質は、膜内領域にあるβ-シートに引き伸ばされ、RsePやホモログタンパク質が共通して持っているアスパラギン残基(N)によって固定されて、切断されると推定される。
今後の展開
RsePのホモログタンパク質は、人を含めさまざまな生物に存在しており、アミノ酸配列の比較から、それらホモログタンパク質の多くが基質を取り込むためのゲートを持つと推定されます。その一方で、機械学習による構造予測に基づいて比較すると、ゲートと推定される領域の構造は進化的に遠い生物では大きく異なっていることも示唆されています。したがって、今後、ゲートを介した基質の取り込みの仕組みを詳しく調べていくことで、RsePやホモログタンパク質の機能を特異的に阻害することが可能になると期待されます。特に、結核菌やコレラ菌などの病原菌がもつRsePのホモログタンパク質は、細菌感染症に関与することも報告されていることから、病原菌のホモログタンパク質に特異的に作用する阻害剤は、新規の感染症治療薬として応用できる可能性があります。さらには、今後、ゲートに着目して、γ-セクレターゼなど、他の膜内切断プロテアーゼの働きを調べていくことで、アルツハイマー病やがんなど、さまざまな病気の発症機構の理解や新たな治療法の開発につながることも期待されます。
特記事項
論文情報
タイトル: Mechanistic insights into intramembrane proteolysis by E. coli site-2 protease homolog RseP
著者: Imaizumi Y, Takanuki K, Miyake T, Takemoto M, Hirata K, Hirose M, Oi R, Kobayashi T, Miyoshi K, Aruga R, Yokoyama T, Katagiri S, Matsuura H, Iwasaki K, Kato T, Kaneko MK, Kato Y, Tajiri M, Akashi S, Nureki O, Hizukuri Y, Akiyama Y, Nogi T.
掲載雑誌: Science Advances
DOI: 10.1126/sciadv.abp9011
本研究は、科研費、AMED創薬等支援技術基盤プラットフォーム事業(PDIS)、 AMED創薬等先端技術支援基盤プラットフォーム(BINDS)、AMED生命科学・創薬研究支援基盤事業(BINDS Phase II)、住友財団、アステラス病態代謝研究会、発酵研究所の支援を受けて実施されました。
SDGsの目標
用語説明
- 抗体アフィニティー精製システム(PAタグシステム)
ヒト由来ポドプラニンの部分配列であるPAタグとラット由来のモノクローナルNZ-1抗体を利用した精製システム。12アミノ酸残基からなるPAタグを融合したタンパク質を、NZ-1抗体との非常に高い親和性を利用して高純度に精製する。PAタグはループ状の構造でNZ-1抗体と結合する特性があることから、目的のタンパク質の末端に融合するだけでなく、ループ領域などに挿入することも可能である。
- X線結晶解析
結晶化した物質にX線を照射して回折パターンを解析し、立体構造を決定する研究手法。電子密度マップに基づいて分子モデルを構築することで、原子間の結合距離や結合角に関する精密な情報が得られる。タンパク質のような巨大な分子やその複合体にも適用可能な研究手法である。
- 大型放射光施設SPring-8の理研ターゲットタンパクビームラインBL32XU
大型放射光施設SPring-8に設置された生体高分子X線結晶構造解析用ビームラインの一つ。10 μm以下の微小結晶からのX線回折データの収集を可能にするために、高フラックスのX線ビームを1 μm以下に集光できるように設計されている。2010年にユーザー利用が開始されて以降、受容体やトランスポーターなど、数多くの膜タンパク質の結晶構造が決定されてきた。
- 化学修飾実験
タンパク質の特定の官能基を試薬により化学的に修飾することで、その機能を変化させたり、構造情報を読み取る実験手法。本研究では、側鎖にSH基をもつシステイン残基を特定の位置に導入したRseP変異体を系統的に作製し、生きた細胞中で発現させ、サイズや性質の異なるSH基修飾試薬によりシステイン残基が修飾される度合いを調べることで、細胞膜に組み込まれた状態のRsePにおける各ドメインの配置を推測した。

