骨を作る細胞たちは微粒子を出し合って情報交換していた!
世界初!生体イメージングが捉えた骨形成のリアルな現場
研究成果のポイント
- 独自に立ち上げた最先端の生体骨イメージング技術により、骨を作る骨芽細胞が細胞外に微粒子(小胞)を分泌することを発見した。
- これまで骨形成から骨吸収への移行メカニズムは不明であったが、骨芽細胞から分泌される細胞外小胞が骨芽細胞の分化を抑制すると同時に、破骨細胞の分化を促進することを明らかにした。
- 今後、この小胞を制御する新たな骨疾患治療薬への応用が期待される。
概要
大阪大学大学院医学系研究科の上中麻希 特任研究員、菊田順一 准教授(生命機能研究科)、石井優 教授(免疫細胞生物学/生命機能研究科/免疫学フロンティア研究センター)らの研究グループは、骨をつくる骨芽細胞が細胞外小胞を分泌し細胞間でやり取りすることで、相互に連携しながら骨の新陳代謝(骨代謝)を制御していることを明らかにしました。
骨は常に新しく作り変えられ新陳代謝を行なっています。破骨細胞が古く傷んだ骨を壊し、その後骨芽細胞が骨を作ります。この骨吸収と骨形成のバランスが崩れると、骨粗しょう症など、様々な病気を引き起こします。これまで、骨吸収から骨形成へ移行する際に働く因子については数多く報告されてきましたが、骨形成から骨吸収へどのように移行するかはよくわかっていませんでした(図1)。
今回、研究グループは、これまでに独自で開発した生体イメージング技術をさらに改良し、生体内で骨芽細胞が細胞外小胞と呼ばれる微粒子を分泌することを発見しました。さらに、小胞を取り込んだ周囲の骨芽細胞が、「骨形成を抑制する作用」と「骨吸収を担う破骨細胞の分化を誘導する作用」を持ち、骨形成から骨吸収へと骨代謝を制御していることを見出しました。また、このメカニズムとして、小胞中に含まれるマイクロRNAのmiR-143-3pが寄与していることも明らかにしました。
今回の研究成果によって、骨粗しょう症など骨疾患に対する新たな治療薬への応用が期待されます。
本研究成果は、英国科学誌「Nature Communications誌」に、2月24日(木)午後7時(日本時間)に公開されました。
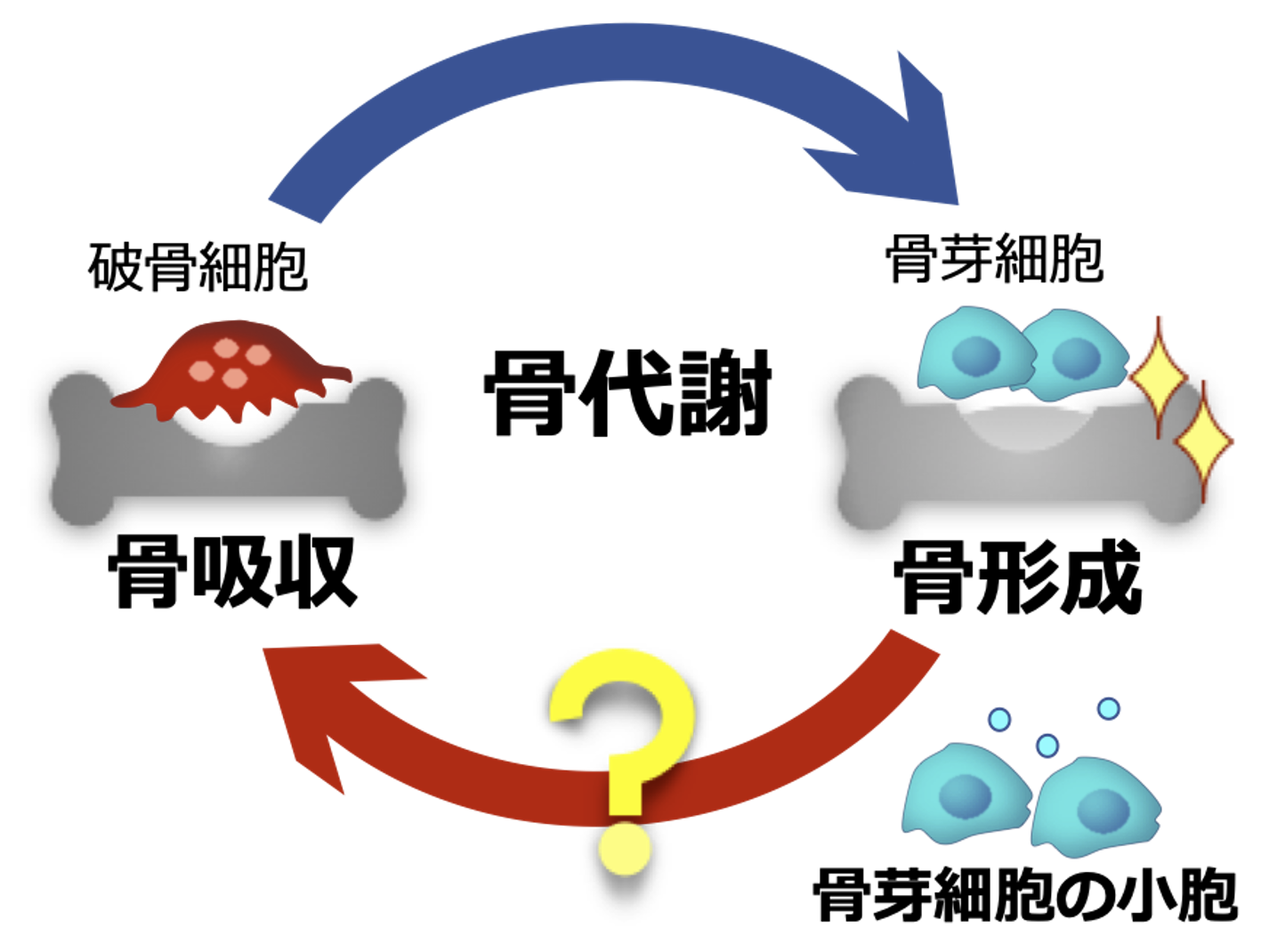
図1. 骨の新陳代謝(骨代謝)の概念図
骨形成から骨吸収へ進める因子として骨芽細胞の小胞を同定した。
研究の背景
骨は常に新しく作り変えられ新陳代謝を行なっています。破骨細胞による骨吸収と、骨芽細胞による骨形成が絶えず繰り返され、骨構造を緻密に維持しています。骨粗しょう症などの骨疾患では、骨吸収と骨形成のバランスが崩れるのみでなく、骨の代謝サイクルにも異常を来すことが知られています。
これまで骨代謝において、骨吸収から骨形成へ移行する際に働く因子については数多く報告されてきましたが、もうひとつのベクトルである、骨形成から骨吸収へどのように移行するかはよくわかっていませんでした。
本研究の成果
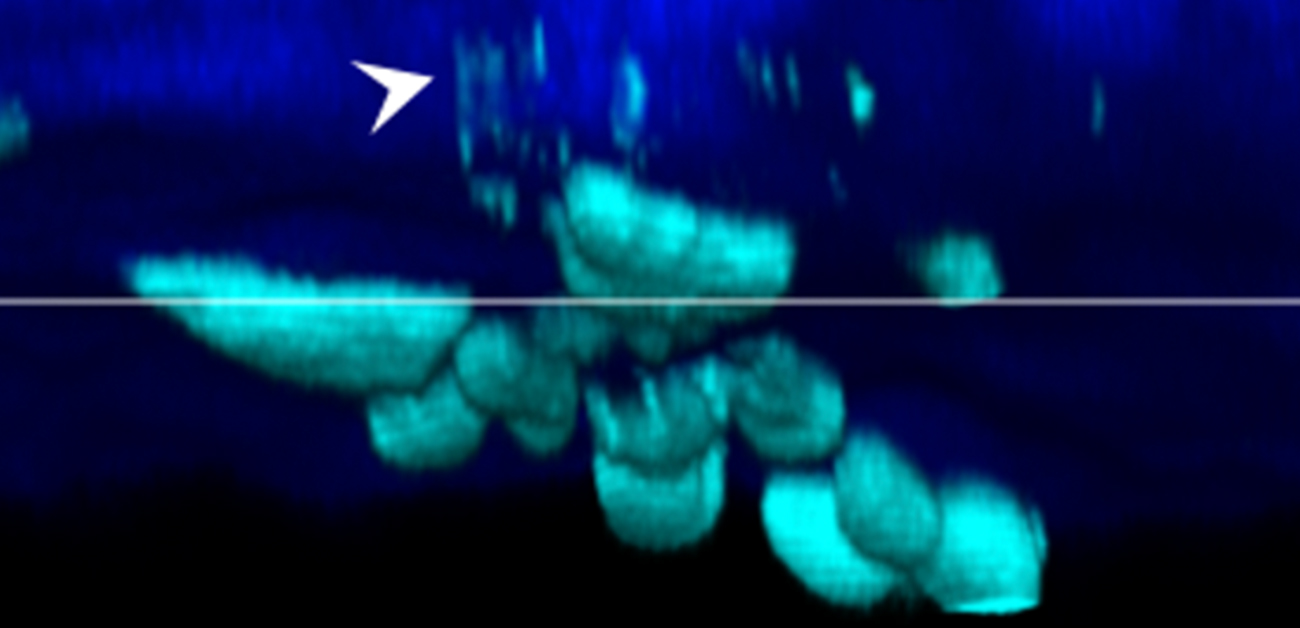
今回、研究グループは、これまで独自に開発した生体イメージング技術をさらに改良し、骨組織に存在する細胞外小胞と呼ばれる小さな粒子を可視化することに成功しました。そしてマウス生体内において、骨を作る骨芽細胞が細胞外小胞を分泌することを発見しました(図2)。
分泌された細胞外小胞を回収し培養骨芽細胞に投与したところ、小胞を取り込んだ骨芽細胞は、骨をつくるために必要な石灰化機能が低下し、骨芽細胞分化に必要なRUNX2(ランクス2)の発現量が低下しました。また、小胞を取り込んだ骨芽細胞は、骨吸収を行う破骨細胞の分化に必要なRANKL(ランクル)を分泌し、破骨細胞分化を誘導しました。すなわち細胞外小胞を取り込んだ骨芽細胞は、新たな骨形成を抑制する作用を持つと同時に、骨吸収を行う破骨細胞分化を誘導する作用を持つことがわかりました(図3)。
さらにそのメカニズムとして、骨芽細胞が出す細胞外小胞に多く含まれるマイクロRNAのmiR-143-3pが寄与していることをRNAシーケンスを用いた解析、ノックアウトマウス解析を通して明らかにしました(図4)。
このことから、骨芽細胞は細胞外小胞を互いに交換し、骨形成から骨吸収へと移行する骨代謝回転に寄与していることが明らかとなりました(図5)。

図2. マウス生体内での骨芽細胞の様子
骨芽細胞が小胞を分泌し取り込んでいることを明らかにした。シアン:骨芽細胞;青色:骨;矢頭:骨芽細胞の小胞。点線矢印:小胞の軌跡。A. 広域像;Bar:20μm;B. 拡大像のタイムラプス画像;Bar:5μm。

図3. 小胞を投与した骨芽細胞の機能
A. 小胞を投与した骨芽細胞は切開化能が低下した。
赤色:石灰化;Bar:200μm。
B. 小胞を投与した骨芽細胞は、破骨細胞分化を誘導した。赤色:破骨細胞;Bar:100μm。
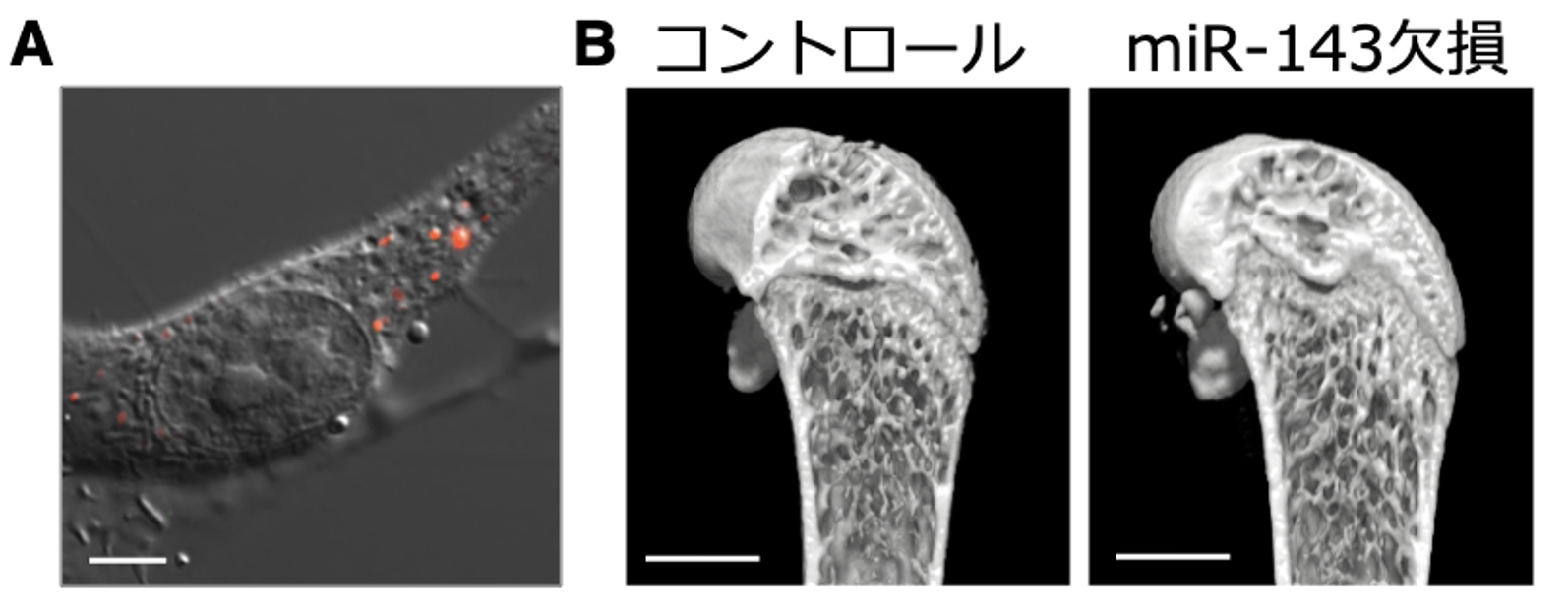
図4. 小胞を投与した骨芽細胞の機能
A. miR-143を含む小胞を取り込んだ骨芽細胞。
赤色:miR-143;Bar:5μm。
B. miR-143欠損マウスでは骨量が増加する。
マウス大腿骨遠位端のマイクロCT解析;Bar:1mm。
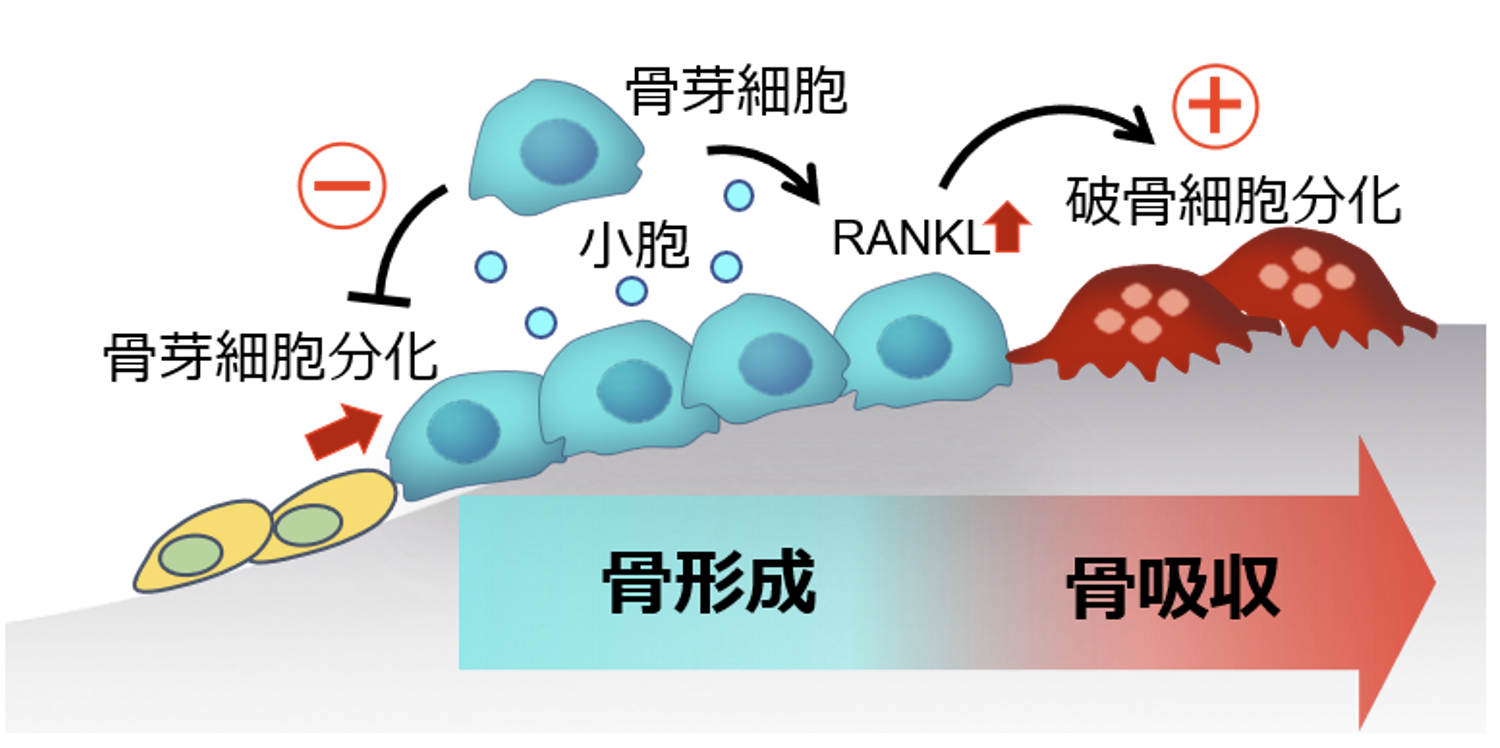
図5. 小胞を取り込んだ骨芽細胞は骨芽細胞の分化を抑制し破骨細胞を誘導する。
本研究成果が社会に与える影響(本研究成果の意義)
高齢者の多くが罹患する骨粗しょう症をはじめ、骨折、骨腫瘍、骨軟化症といった骨疾患は、骨吸収と骨形成の骨代謝バランスが大きく寄与しています。本研究成果により、骨吸収から骨形成のみでなく、骨形成から骨吸収へ移行を促す因子が明らかになったことにより、より生理的な骨代謝サイクルを維持し、健康な骨代謝バランスへと導く、新たな治療法の開発につながることが期待されます。
特記事項
本研究成果は、2022年2月24日(木)午後7時(日本時間)に英国科学誌「Nature Communications誌」(オンライン)に掲載されました。
【タイトル】 “Osteoblast-derived vesicles induce a switch from bone-formation to bone-resorption in vivo ”
【著者名】 Maki Uenaka1, Erika Yamashita1, Junichi Kikuta1,2,3, Akito Morimoto1, Tomoka Ao1,3, Hiroki Mizuno1,2, Masayuki Furuya1, Tetsuo Hasegawa1, Hiroyuki Tsukazaki1, Takao Sudo1,2, Keizo Nishikawa1,2, Daisuke Okuzaki4, Daisuke Motooka4, Nobuyoshi Kosaka5, Fuminori Sugihara6, Thomas Boettger7, Thomas Braun7, Takahiro Ochiya5, Masaru Ishii1,2,3
【所属】
1 大阪大学 大学院医学系研究科・生命機能研究科 免疫細胞生物学
2 大阪大学 免疫学フロンティア研究センター
3 医薬基盤・健康・栄養研究所 創薬イメージングプロジェクト
4 大阪大学 微生物病研究所 遺伝情報実験センター
5 東京医科大学 医学総合研究所 分子細胞治療研究部門
6 大阪大学免疫学フロンティア研究センター 中央実験室
7 Max-Plank-Institute for Heart and Lung Research
本研究は、科学技術振興機構戦略的創造研究推進事業(PRESTO, JPMJPR18HA)、日本学術振興会科学研究費助成事業(基盤研究S, 19H05657)の支援を受け、実施しました。
用語説明
- 生体イメージング技術
実験動物を生かしたまま顕微鏡に乗せ、臓器内部の細胞や分子の動きをリアルタイムで解析する手法。特殊な顕微鏡を使用することで、硬い石灰質に囲まれた骨の内側を生きたまま観察し、骨代謝に関わる細胞の挙動を解析することができる。
- マイクロRNA
タンパク質を作りださない短鎖(20-25塩基)のRNA。マイクロRNAは、自身と同じ配列をもつ遺伝子のメッセンジャーRNAに結合し、そのメッセンジャーRNAを分解したり、タンパク質への翻訳を阻害したりすることでその遺伝子の発現を抑制する作用をもつ。
- RUNX2(ランクス2)
Runt-related transcription factor 2。骨芽細胞分化および軟骨細胞分化に必須な転写因子であり、骨芽細胞分化を誘導することで骨形成を促進させることができる。
- RANKL(ランクル)
receptor activator of nuclear factor-kappa B ligand。単球系細胞が破骨細胞へ分化するために必須のサイトカインの一つであり、抗RANKL抗体はヒトにおいて骨粗鬆症や関節リウマチの治療薬として用いられている。
- RNAシーケンス
細胞に含まれるメッセンジャーRNAやマイクロRNAの配列を解読し、細胞内の発現を定量解析する手法。
- ノックアウトマウス解析
標的遺伝子を意図的に欠損させたノックアウトマウスを用い、その遺伝子の機能を解析する手法。
