脳梗塞後の神経細胞死を防ぐ新規遺伝子を発見
脳梗塞の予後を改善する新たな治療法の開発に期待
研究成果のポイント
- 脳梗塞マウスモデルを用いて、脳梗塞後の神経細胞死を防ぐのに重要な遺伝子を発見。
- これまで転写因子Npas4は脳梗塞後の神経細胞死を抑制するのに必須であるが、その下流で働く遺伝子はほとんど解明されておらず、今回in vitro脳虚血様負荷モデルを駆使することで、新たにGem(低分子量Gタンパク質)を発見。
- Gemはヒト大脳皮質オルガノイドでも、脳梗塞後にその発現が見られたことから、脳梗塞に対する新たな創薬ターゲットとして期待。
概要
大阪大学大学院生命機能研究科の坪井昭夫特任教授と香川大学医学部の高橋弘雄助教らの研究チームは、脳梗塞後の神経細胞死を防御するのに、転写因子Npas4の新規な下流遺伝子が重要な役割を果たすことを世界で初めて明らかにしました(図1)。Npas4が、健常脳の神経回路形成や、脳梗塞後の神経細胞の生死を制御するのに必須であることは知られていましたが、損傷脳でその下流で働く遺伝子についてはほとんど解明されていませんでした(図1)。
今回、研究チームは、脳梗塞マウスモデルやin vitro脳虚血様負荷モデルを駆使することすることにより、Npas4の下流で働く新規遺伝子のGemが神経細胞死を抑制するのに重要であることを解明しました。これにより、Gemは脳梗塞に対する新たな創薬ターゲットとして期待されます。
本研究成果は、米国科学アカデミー紀要「PNAS」に、8月3日(火)5時(日本時間)に公開されました。
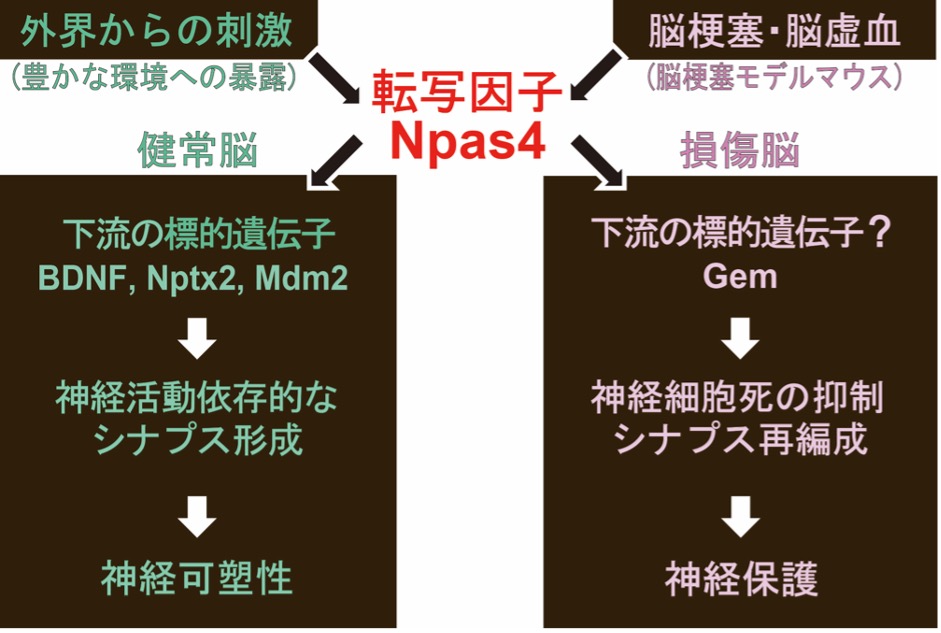
図1. 脳梗塞後に発現が誘導される転写因子Npas4及び、その下流の標的遺伝子Gem
研究の背景
脳血管疾患は、本邦死因の4位となる発生頻度の高い疾患です。しかし、脳血管疾患の多くを占める脳梗塞(脳虚血)により脳が損傷した場合、失われた神経細胞や回路を補填するのに有効な治療法は未だに確立されていません。また脳血管疾患は認知症と並び、要介護者を生む最大の要因です。そこで、「脳梗塞により破綻した脳の構造や機能を、どのようにして再構築し、修復するのか?」は、超高齢化社会において極めて重要な問題です。
これまで脳梗塞(脳虚血)では、グルタミン酸の過剰な放出により、細胞内のグルタミン受容体が過剰に活性化され、過剰なCa2+が流入することで、神経細胞に脱分極が生じ、そのような異常な脱分極は梗塞部位のみならず、周囲の神経細胞に伝搬することで細胞死をもたらすと考えられています。また、脳梗塞後の初期に転写因子Npas4の発現が梗塞部位の周囲の神経細胞で強く誘導され、神経細胞の生死を制御することは示唆されていましたが、その下流で働く遺伝子についてはほとんど解明されていませんでした。
坪井特任教授らの研究チームは、マウスを通常のケージから移し、おもちゃなどを加えた刺激の多いケージ(豊かな環境[EE: Enriched environment])で短時間飼育した後に、脳梗塞手術を行うと、驚くべきことに神経細胞死が減少することを見出しました(図2)。これは、マウスを豊かな環境にさらすことで、大脳皮質ニューロンにおいてNpas4遺伝子の発現が著しく上昇したことによると考えられます(図3)。また、Npas4遺伝子の欠損マウスでは、豊かな環境にさらしても、逆に神経細胞死が増加することから、Npas4は脳梗塞後の神経細胞死の抑制(神経保護)に必要であることがわかりました(図3)。
さらにin vitro脳虚血様負荷モデル(図4)を用いて、Npas4の下流遺伝子を系統的に検索した結果、神経保護に直接関与する低分子量Gタンパク質Gemの同定に成功しました(図5)。また、マウスの脳であらかじめGem遺伝子を一過性に発現させると、脳梗塞後の神経細胞死が顕著に減少することから、GemはNpas4の下流で神経細胞死の抑制(神経保護)に重要な役割を果たすことがわかりました(図6)。
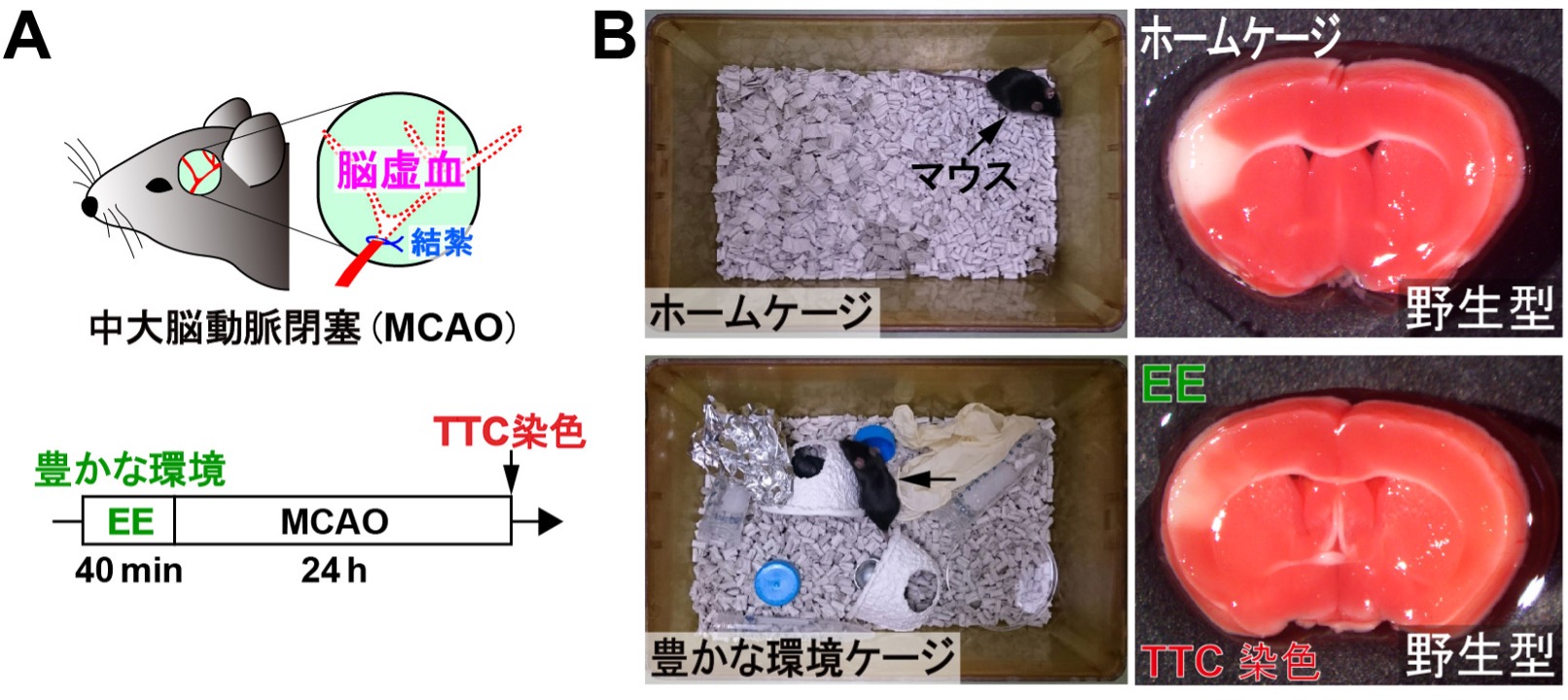
図2. 刺激が豊かな環境(EE)への短時間暴露はMCAO手術後の梗塞巣のサイズを減少させる
(A)MCAO手術と実験のタイムラインを模式的に示した図。TTCは2,3,5-トリフェニルテトラゾリウムクロライド。
(B)MCAOの24時間後に生細胞をTTCで染色しました。野生型マウスは、40分間EEに事前にさらされたことで、MCAO手術後の梗塞巣のサイズが減少する、即ち、神経細胞死が抑制されることがわかりました。
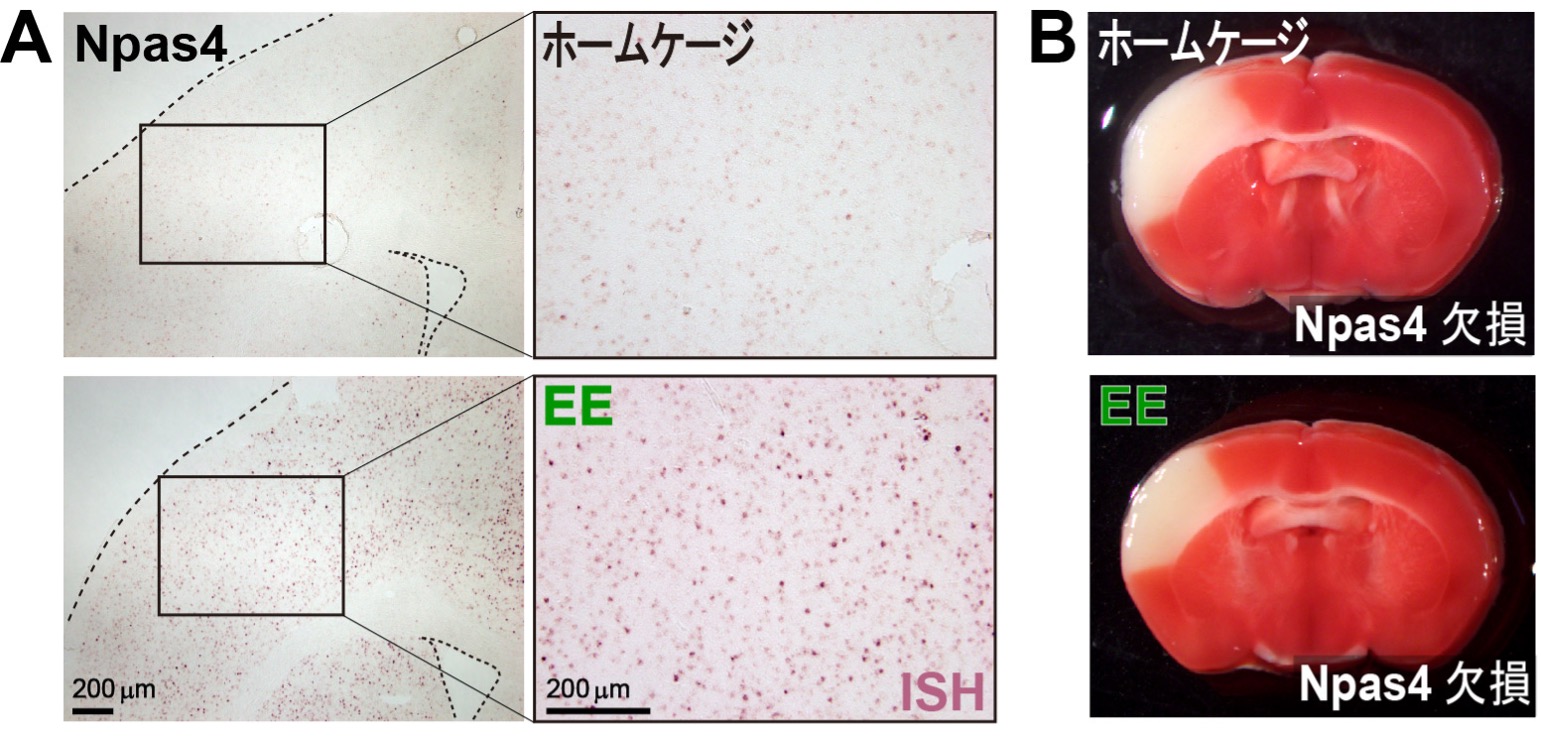
図3. 刺激が豊かな環境(EE)への短時間暴露はNpas4の発現を誘導する
(A)ISH(in situ hybridization)法により、EE暴露後の大脳皮質におけるNpas4の発現を示します。
(B)MCAOの24時間後に生細胞をTTCで染色しました。Npas4欠損マウスではEEにさらされても、MCAO手術後の梗塞巣のサイズが増大する、即ち、神経細胞死が抑制されないことがわかりました。
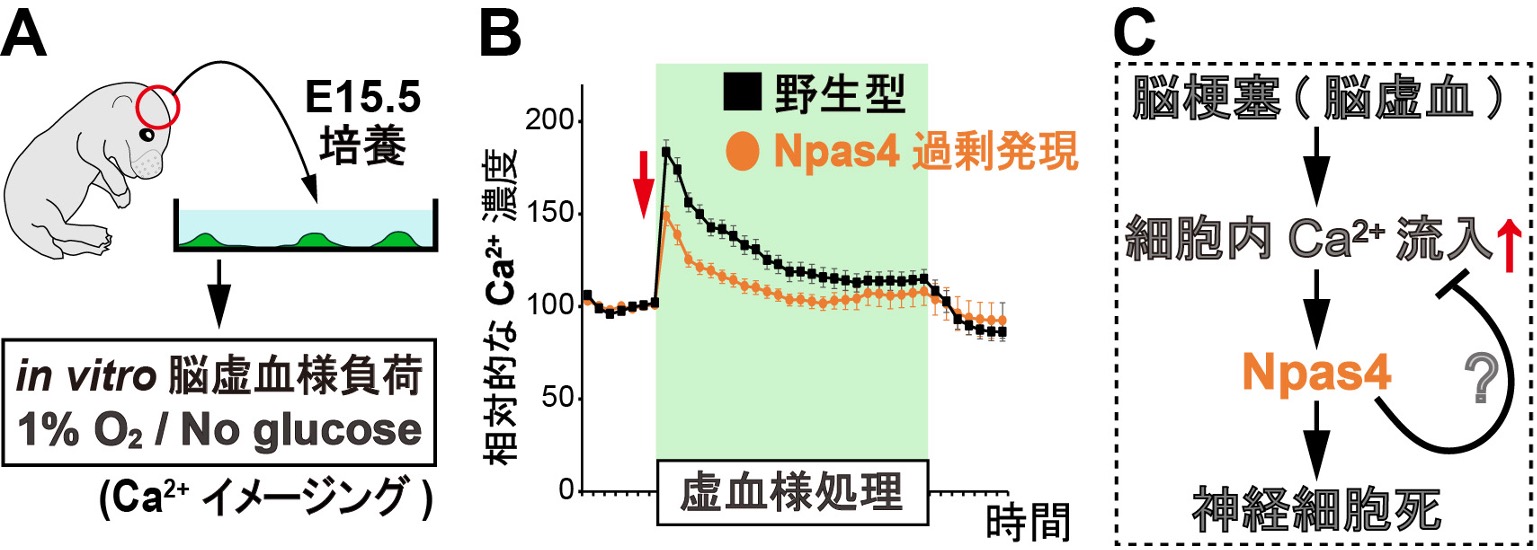
図4.脳虚血に伴う細胞内へのCa2+流入に対するNpas4の過剰発現の効果
(A)初代培養した大脳皮質ニューロンに対してin vitro脳虚血様負荷を10分間与えると、過剰な細胞内Ca2+流入が生じ、細胞死に至ります。
(B)初代培養ニューロンでNpas4を過剰発現させると、脳虚血様負荷による細胞内Ca2+濃度の上昇が顕著に抑制されました。
(C)Npas4の発現は脳虚血時の細胞内Ca2+流入を抑えることにより、神経細胞死を抑制すると考えられます。
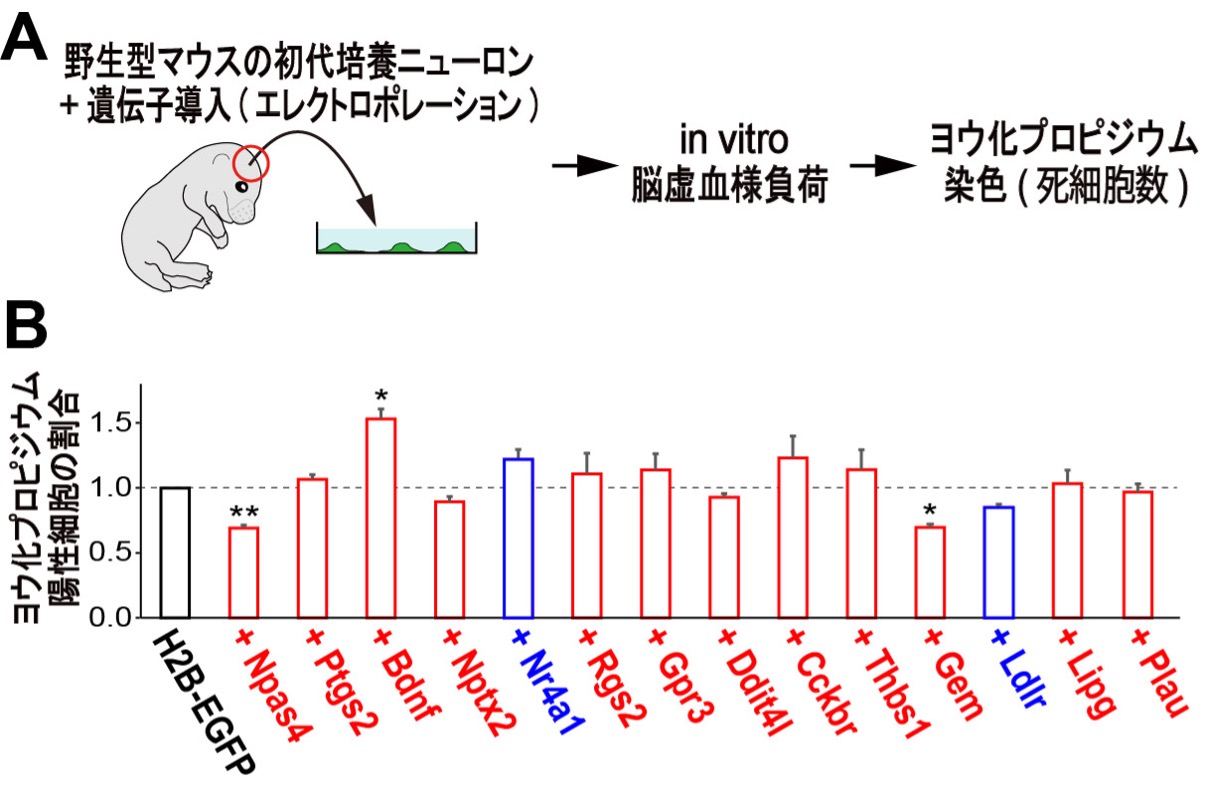
図5. 脳虚血による神経細胞死を抑制するNpas4の下流遺伝子の探索
(A)Npas4の下流遺伝子のスクリーニングを模式的に示した図。
(B)初代培養ニューロンでH2B-EGFP(コントロール)と13個の候補遺伝子をそれぞれ共発現させたものに対して、in vitro脳虚血様負荷を10分間与え、24時間後にヨウ化プロピジウム染色を用いて死細胞の数を算出しました。その結果、Npas4に加えて、新規遺伝子であるGemの発現が虚血様負荷後の神経細胞死を減少させることがわかりました。遺伝子名の色は、Npas4欠損マウス由来の初代培養ニューロンに対してin vitro脳虚血様負荷を10分間与えた際に、その発現が減少したものを赤で、増加したものを青で示します。
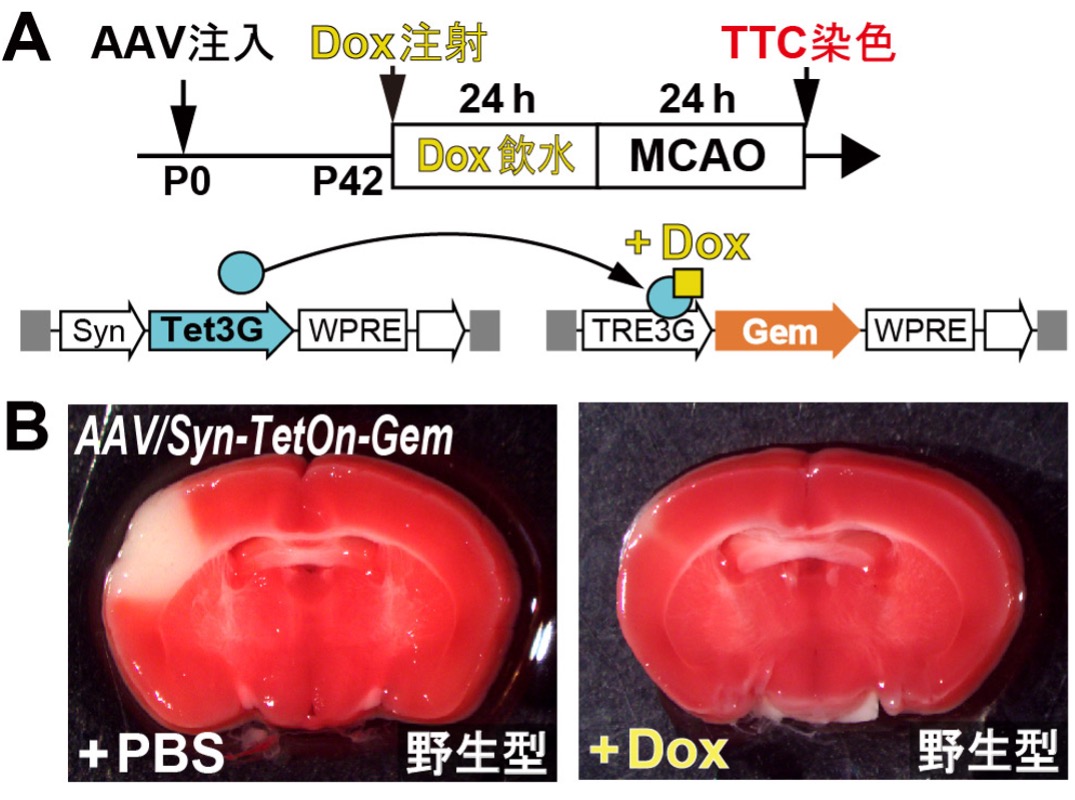
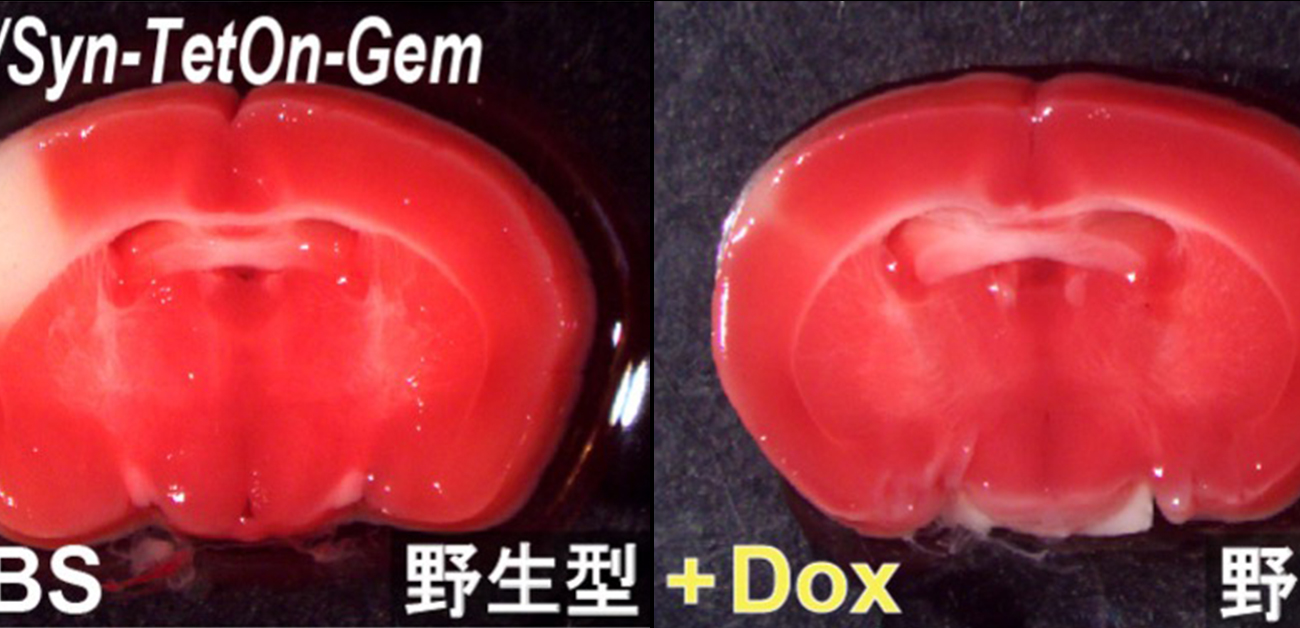
図6. マウス脳であらかじめGemを一過性に発現させると、脳梗塞後の神経細胞死が著しく減少する
(A)MCAO手術前にアデノウィルスAAV/Syn-TetOnシステムを用いて、Gemを過剰発現させた実験の模式図。生後0日目(P0)の野生型仔マウスの脳室に、2種類のアデノウィルス(AAV/Syn-Tet3GとAAV/TRE3G-Gem)を同時に注入しました。42日後にマウスをPBS(Phosphate-buffered saline)またはDox(Doxycycline)で処理した後に、MCAO手術を行いました。その24時間後にTTC染色を行い、梗塞巣のサイズを測定しました。
(B)野生型マウスの脳であらかじめGem遺伝子を一過性に発現させると、脳梗塞後の神経細胞死が著しく減少することがわかりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、脳梗塞後の神経保護にはNpas4を介したGem遺伝子の発現が重要であることが明らかになりました。さらに、Gemはヒト大脳皮質オルガノイドにおいても脳梗塞様の処理により、その発現が誘導されることから、脳梗塞治療の新たな創薬ターゲットとして期待されます。
現在の脳梗塞治療法は、t-PA(組織プラスミノゲン活性化因子)を用いた血栓溶解療法など、「血流を速やかに回復して既存の神経回路を守る」という点に重点を置いたもので、出血傾向を有する患者さんには適用できません。そこで、Gemを標的とした新規治療法は出血傾向のある患者さんにも適用できると期待されます。
特記事項
本研究成果は、2021年8月3日(火)5時(日本時間)に米国科学アカデミー紀要「Proceedings of the National Academy of Sciences of the United States of America」(オンライン)に掲載されました。
タイトル:Ras-like Gem GTPase induced by Npas4 promotes activity-dependent neuronal tolerance for ischemic stroke
著者名:Takahashi H, Asahina R, Fujioka M, Matsui TK, Kato S, Mori E, Hioki H, Yamamoto T, Kobayashi K, Tsuboi A
なお、本研究は、香川大学 医学部医学科の高橋弘雄博士、奈良県立医科大学 医学部医学科の森英一郎博士らの協力を得て行われました。また、KAKEN 基盤研究(B)(C)・新学術領域研究(適応回路シフト)・挑戦的研究(萌芽)、AMED「橋渡し研究戦略的推進プログラム」大阪大学拠点シーズA、及び、武田科学振興財団(特定研究)・喫煙科学研究財団・日本応用酵素協会をはじめとする多くの研究助成により遂行されました。
用語説明
- 脳梗塞マウスモデル
中大脳動脈閉塞(MCAO: middle cerebral artery occlusion)マウスは、右側の中大脳動脈をナイロン糸で結紮することにより、作製しました(図2)。
- 転写因子Npas4
転写因子Npas4は神経活動により速やかに誘導される最初期遺伝子の1つであり、その下流遺伝子の発現を制御することで、健常脳において神経活動依存的にシナプスの形成を促進することが知られている。
- in vitro脳虚血様負荷モデル
胎生15.5日齢のマウス胎児から大脳を摘出し、細胞をバラバラにした後、ペトリディッシュで7日間培養した初代ニューロンに対して脳虚血様負荷を与えると、グルタミン酸の過剰な放出により、細胞内のグルタミン受容体が過剰に活性化され、過大なCa2+流入が生じ、細胞死に至ります(図4)。
- Gem(低分子量Gタンパク質)
Gemは、低分子量Gタンパク質の5つのファミリーの中のRasファミリーに属し、互いに相同性の高いRem, Rad, Gem/Kirと共にRGKサブファミリーを形成して、電位依存性Ca2+チャネルの細胞内局在などを制御することが知られています。
- ヒト大脳皮質オルガノイド
ヒトiPS細胞を単一の細胞ではなく、複数の細胞からなるオルガノイド(臓器様細胞塊)に分化させるもので、三次元培養系を駆使することで、分化させた大脳皮質オルガノイドに対して脳虚血様負荷を与えた後に、Gemの発現が誘導されるかどうかを調べました。
- 豊かな環境[EE: Enriched environment]
おもちゃなどを加えた刺激の多いケージ(豊かな環境)で飼育された動物では、記憶・学習能力が向上したり,脳損傷後の機能回復が促進したりすることが知られていますが、その仕組みについては良く分かっていませんでした(図2)。
