数十年もいる謎。ピロリ菌の持続感染メカニズムを解明
ピロリ菌のsmall RNAが発がんを制御する
研究成果のポイント
概要
大阪大学 微生物病研究所の木下 遼 助教、三室 仁美 准教授らの研究グループは、ヒトに胃がんを発症させるピロリ菌が、small RNAによって病原因子の発現を調節して胃内環境に適応し、持続感染と胃がんを引き起こすことを明らかにしました。
ピロリ菌は世界人口の約半数が感染している大規模感染症で、ヒトの胃内で何十年にもわたる付着感染の末に、発がん因子CagAの作用によって、萎縮性胃炎、胃潰瘍、胃がんなどの消化器疾患を引き起こすことが知られています。しかしながら、ピロリ菌がどのように胃内環境に適応して長期間感染し、発がん因子産生を調節するのかは解明されていませんでした。
今回、三室 准教授らの研究グループは、ピロリ菌を感染させたマウスやスナネズミの胃から単離したピロリ菌のゲノムDNA配列とRNA発現量を解析した結果、small RNAのひとつであるHPnc4160の発現が減少していることがわかりました。このHPnc4160が減少すると、発がん因子CagAや新規病原因子群の発現量が増大し、ピロリ菌が胃に感染しやすくなりました。さらに、ピロリ菌が胃に感染しているあいだに、HPnc4160の発現量が増減することで、長期間の感染を維持していることを解明しました。HPnc4160の発現量をターゲットにすることにより、高病原性ピロリ菌感染の診断方法の開発が期待されます。
本研究成果は、英国科学誌「Nature Communications」に、4月9日(金)19時(日本時間)に公開されました。
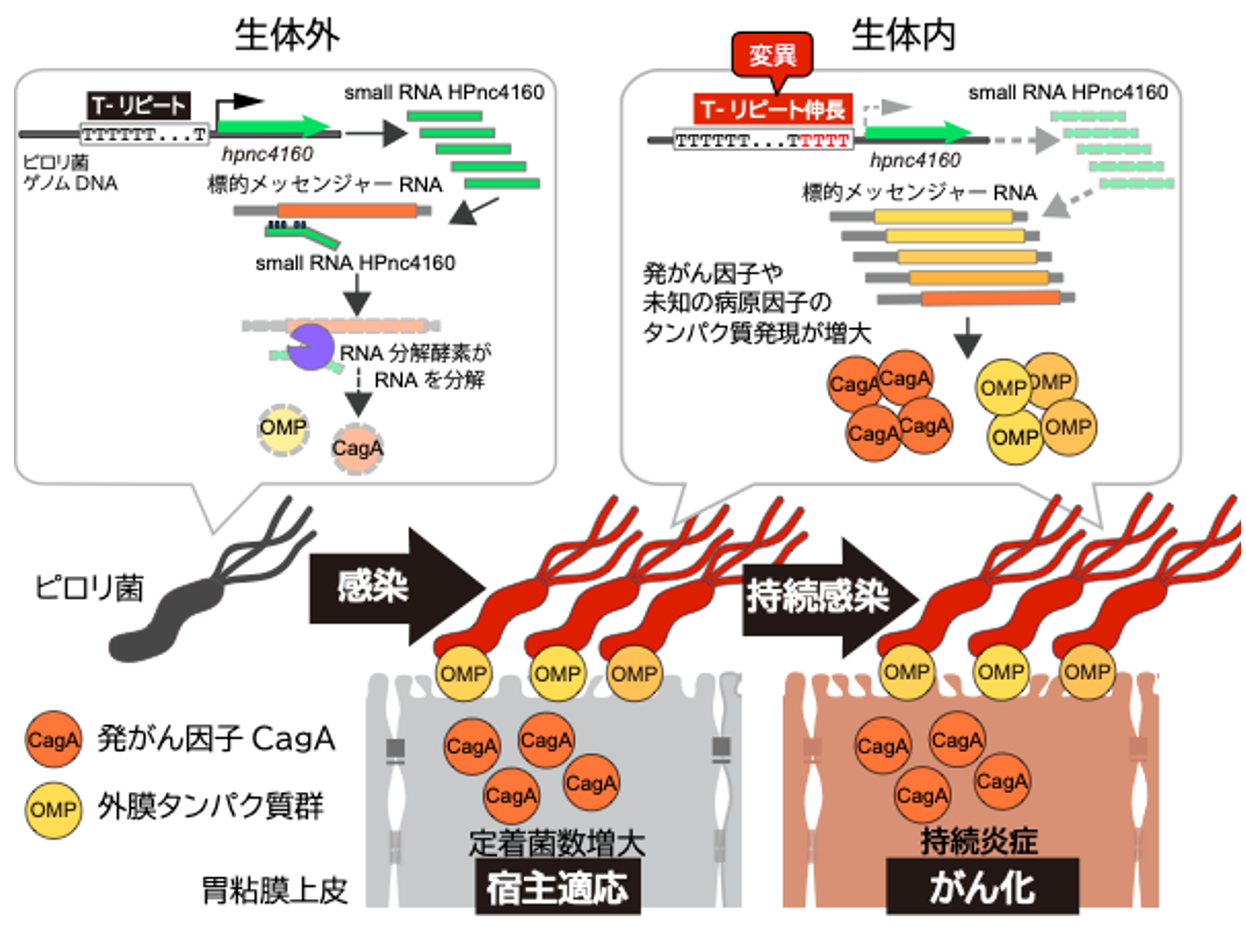
図1. ピロリ菌 small RNA HPnc4160による持続感染とがん化 ピロリ菌のsmall RNA HPnc4160は、病原因子のメッセンジャーRNA発現を抑制している。ピロリ菌が胃粘膜に感染すると、HPnc4160をコードするゲノムの上流域にある、連続するチミジン(T)配列(T-リピート)に、遺伝子変異が導入される。
するとHPnc4160量が減少してしまうために、病原因子タンパク質量が増加して、ピロリ菌が胃粘膜に長期間感染しやすくなる。
研究の背景
これまで、ピロリ菌は幼少期に感染し、数十年後に胃がんを引き起こすことが知られていました。しかしながら、感染をしてもすぐにヒトの体内から排除されてしまう多くの病原細菌とは異なり、ピロリ菌がどのようにヒトの胃内の環境に適応して、何十年もの長期間感染できるのかは解明されていませんでした。
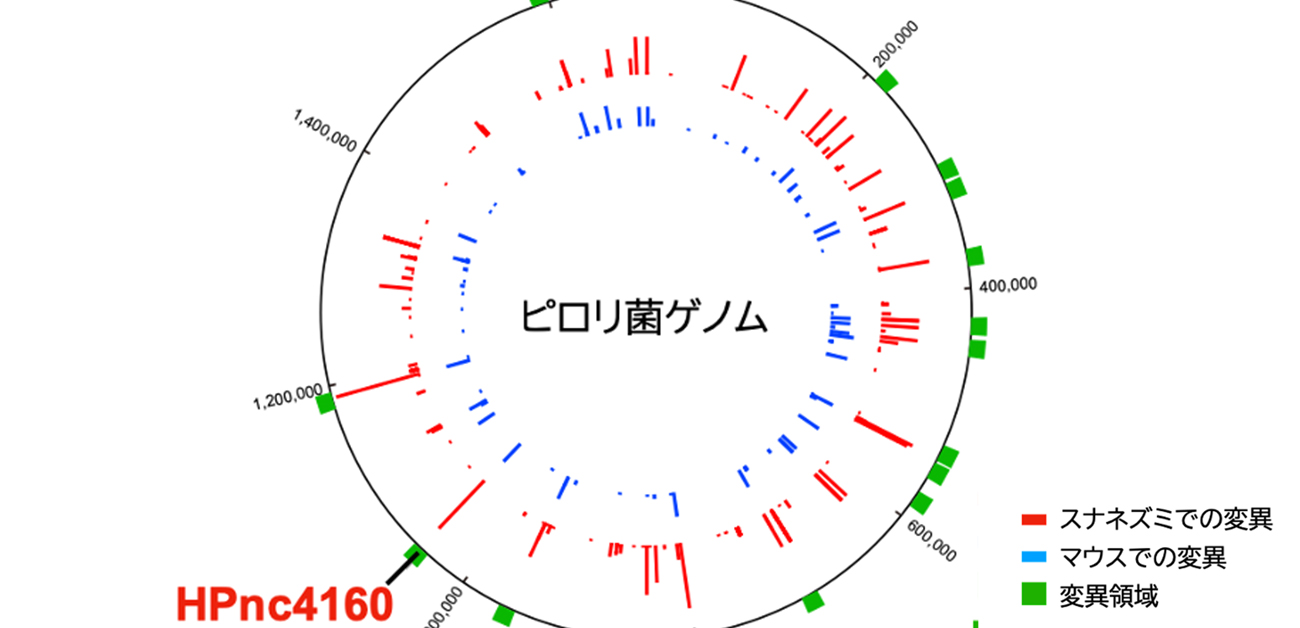
三室 准教授らの研究グループは、ピロリ菌をマウスやスナネズミの胃内に接種したのちに、感染した胃から単離したピロリ菌のゲノムDNAを網羅的に解析し、その結果持続感染において重要なsmall RNA HPnc4160を同定しました(図2および3)。このsmall RNA HPnc4160はピロリ菌の胃粘膜への定着に関与すると言われている外膜タンパク質の発現を調節しているだけではなく、胃がんの発がん因子CagAタンパク質の発現も調節していることを解明しました。
ピロリ菌が胃粘膜に感染すると、HPnc4160をコードするゲノムの上流域にある、連続するチミジン(T)配列(T-リピート)に、遺伝子変異が導入され、T-リピートの長さが長くなっていました。するとHPnc4160量が減少してしまうために、病原因子タンパク質量が増加して、ピロリ菌が胃粘膜に長期間感染しやすくなりました。これらの結果は、動物実験だけではなく、胃がん患者さんより分離されたピロリ菌でも同様でした(図4)。
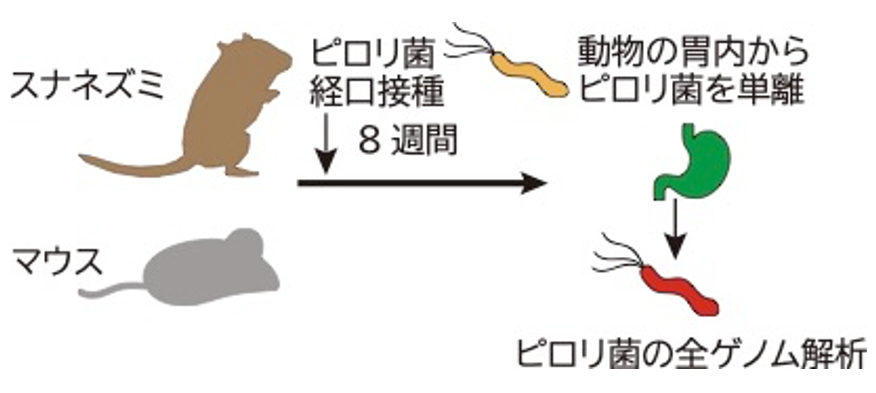
図2. 実験方法 マウスやスナネズミにピロリ菌を飲ませて8週後の胃内から感染しているピロリ菌を単離し、全ゲノム解析を行った。
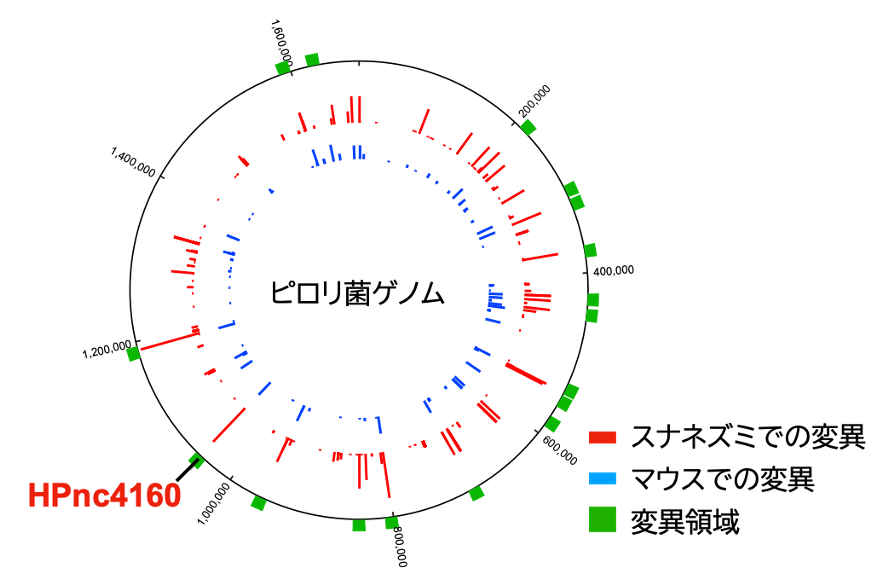
図3. 胃内から単離したピロリ菌のゲノム変異領域 マウスやスナネズミから単離したピロリ菌は、small RNA HPnc4160の上流域に変異が挿入されていた。
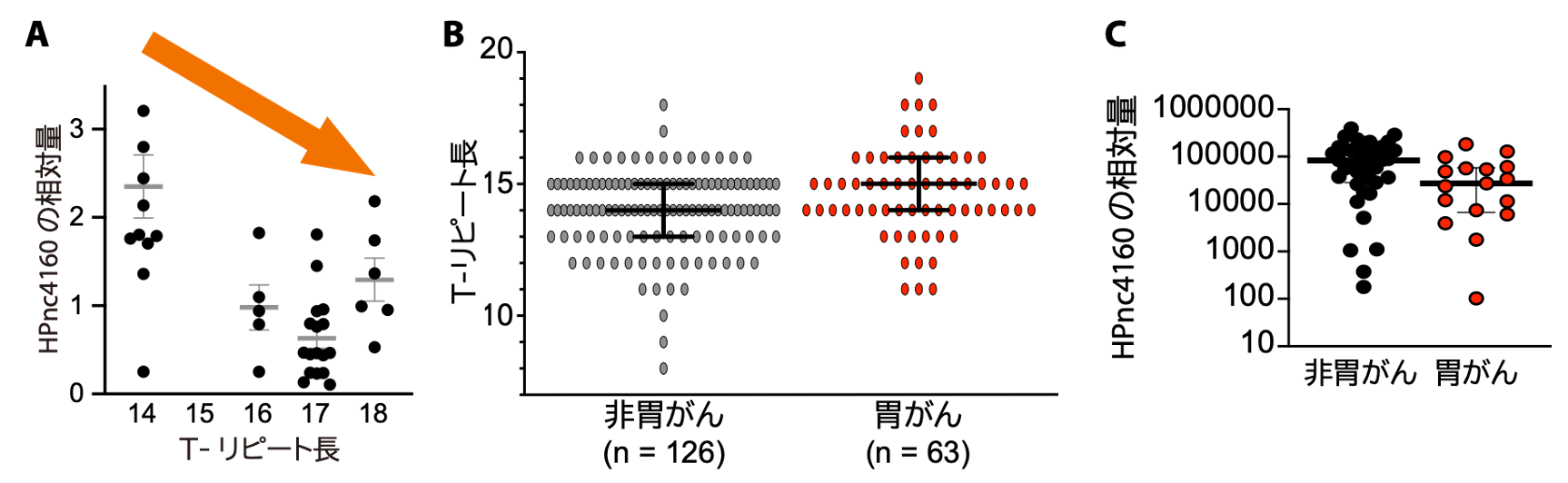
図4. 胃がん患者さん由来臨床分離株では、非胃がん患者さん由来臨床株よりもHPnc4160上流の連続するチミジン (T) 配列 (T-リピート)が長くなり、HPnc4160の発現量が低下していた。 スナネズミの胃から単離したピロリ菌では、small RNA HPnc4160の上流域のT-リピート長が長くなる変異が導入されていた (A)。胃がん患者さんの胃のピロリ菌は、非胃がん患者さんの胃のピロリ菌よりも、T-リピート長が長く (B)、HPnc4160の量が低下していた (C)。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、ピロリ菌の長期間感染と胃がんの発症は、small RNA HPnc4160が制御していることが示されました。これらの結果により、ピロリ菌のsmall RNAの発現やゲノム配列の解析が、高病原性ピロリ菌の診断に有用である可能性を示しました。また、small RNAを制御することで、胃がんを予防する可能性が開かれました。
特記事項
本研究は、筑波大学、九州大学、大分大学、東京医科歯科大学、東京大学との共同研究として実施されました。
また、本研究成果は、2021年4月9日(金)19時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:“A bacterial small RNA regulates the adaptation of Helicobacter pylori to the host environment”
著者名:Ryo Kinoshita-Daitoku, Kotaro Kiga, Masatoshi Miyakoshi, Ryota Otsubo, Yoshitoshi Ogura, Takahito Sanada, Zhu Bo, Tuan Vo Phuoc, Tokuju Okano, Tamako Iida, Rui Yokomori, Eisuke Kuroda, Sayaka Hirukawa, Mototsugu Tanaka, Arpana Sood, Phawinee Subsomwong, Hiroshi Ashida, Tran Thanh Binh, Lam Tung Nguyen, Khien Vu Van, Dang Quy Dung Ho, Kenta Nakai, Toshihiko Suzuki, Yoshio Yamaoka, Tetsuya Hayashi, and Hitomi Mimuro.
参考URL
大阪大学微生物病研究所感染微生物分野(三室研究室)
http://www.biken.osaka-u.ac.jp/laboratories/detail/6
用語説明
- small RNA
mRNA(メッセンンジャーRNA)とは異なり、タンパク質に翻訳されない小さなRNAで、多くのmRNA と結合してタンパク質への翻訳量を制御している。さまざまな生物に多数存在している。
- HPnc4160
ピロリ菌のsmall RNAのひとつ。本研究で、ピロリ菌が胃内に感染すると、ゲノムに変異がはいることで発現量が変化し、複数のタンパク質の発現を変化させることが解明された。このsmall RNAによって、ピロリ菌は、常に変化する胃内環境に適応することができることが明らかになった。
- CagA タンパク質
ピロリ菌が持つ病原性タンパク質で、胃がん発生に関与する。菌の分泌装置から、胃の細胞へ分泌されることが知られている。
- 外膜タンパク質
ピロリ菌の菌体のもっとも外側の膜に存在するタンパク質。多数の種類があるが、機能が明らかになっているものは多くはない。ピロリ菌が宿主細胞に接着するのに関与すると考えられている。
