タンパク質中のトリプトファン残基を特異的に水酸化する新しいフラビン酵素の構造と機能を解明
新規機能性ペプチドの酵素的合成法の開発につながる成果
研究成果のポイント
- タンパク質中のトリプトファン残基を特異的かつ二重に水酸化するフラビン酵素を発見し、その結晶構造と反応機構を世界に先駆けて解明した。
- トリプトファン残基に由来するキノン化合物を補酵素とする各種の酵素が知られていたが、補酵素を作り出す翻訳後修飾酵素の構造、およびその反応メカニズムについては、これまで不明な点が多かった。
- 中程度サイズのタンパク質を基盤とする中分子創薬が創薬の新しいトレンドとして注目されるなか、新規なタンパク質修飾酵素として、各種の生理活性ペプチドの開発に応用することが期待される。
概要
大阪大学産業科学研究所 岡島 俊英准教授と理学研究科大学院生の大関 俊範さん(博士後期課程)、広島工業大学 中井 忠志准教授の研究グループは、酵素の活性中心サブユニットのトリプトファン残基を二重に水酸化する修飾酵素QhpGを発見し、X線結晶構造解析と精密な質量分析によって、その結晶構造(PDB ID: 7CTQ)と反応機構を世界で初めて解明しました(図1)。今回の研究で注目したキノヘムプロテインアミン脱水素酵素(QHNDH)の活性中心サブユニットQhpCは、3ヶ所の分子内架橋構造に加え、トリプトファン残基とシステイン残基に由来するキノン補酵素を含む特異な構造を有しています。QhpGはこの補酵素形成に必須な初期反応を担っていることがわかりました。このようなタンパク質の翻訳後修飾は、タンパク質を構成する基本的な20種類のアミノ酸の機能を拡張する重要かつ基本的な生体内反応であり、今回の研究はその精緻なメカニズムの一端を分子レベルで明らかにしています。QhpGは、新規なタンパク質修飾のツールとして、各種の生理活性ペプチドの開発に応用することも期待されます。
本研究成果は、英国科学誌「Nature Communications」に、2月10日(水)19時(日本時間)に公開されました。
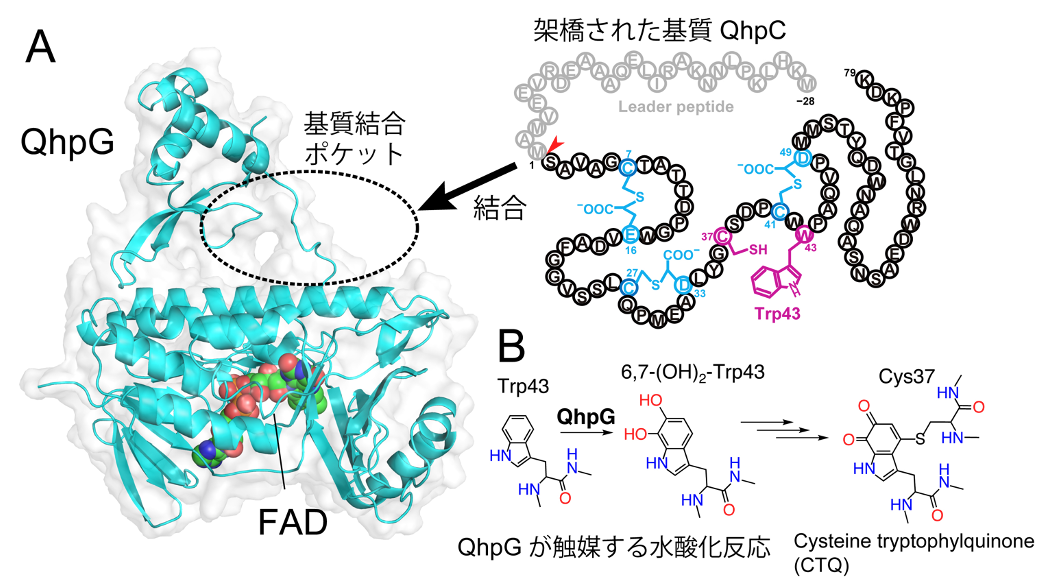
図1 (A)QhpGの結晶構造と架橋された基質QhpCの模式図。FADを含む触媒サブユニットと小サブユニット間のポケットに、基質QhpCが結合する。(B)QhpGが触媒する水酸化反応。
発表者
大関 俊範:大阪大学 産業科学研究所、大阪大学大学院理学研究科博士後期課程、日本学術振興会特別研究員DC
中井 忠志:広島工業大学生命学部准教授、大阪大学 産業科学研究所 招へい准教授
小酒井 一輝:大阪大学産業科学研究所、大阪大学大学院理学研究科 博士前期課程
岡本 一起:大阪大学 産業科学研究所 特任准教授
黒田 俊一:大阪大学 産業科学研究所 教授
小林 一雄:大阪大学 産業科学研究所 特任教授
谷澤 克行:大阪大学 産業科学研究所 招へい教授、大阪大学名誉教授
岡島 俊英:大阪大学 産業科学研究所 准教授
研究の背景
多くの酵素はタンパク質以外に補酵素と呼ばれる有機低分子を含み、その高い反応性を利用して、常温常圧で効率的に各種の化学反応を触媒します。一般的に、多くの補酵素は酵素本体のタンパク質とは別にB群ビタミンなどから体内で生合成されたのち、酵素に取り込まれて機能します。しかし、一部の補酵素はタンパク質を構成するアミノ酸残基が翻訳後修飾によって変換されることで作り出されます。このようなビルトイン型補酵素の一つとして、これまでにも、各種の酵素において、トリプトファン残基がキノン補酵素に作り変えられていることが知られていましたが、それを作り出す酵素の構造と機能、その形成メカニズムは、ほとんど解明されていませんでした。
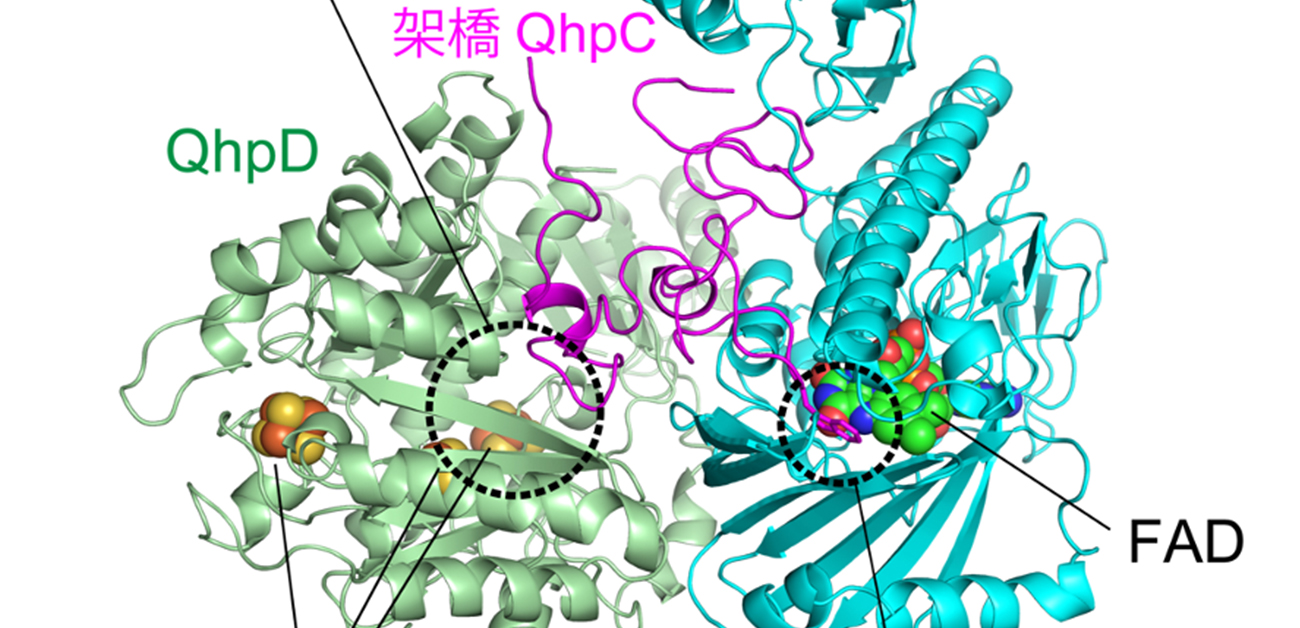
今回、研究対象としたQHNDH は、異なる3つのサブユニットabgから構成され、そのうち最も小さなgサブユニット(QhpC)には、3ヶ所の分子内チオエーテル架橋構造に加え、トリプトファン残基とシステイン残基に由来するキノン補酵素:システイントリプトフィルキノン(CTQ)という2種類の特異な翻訳後修飾構造が含まれています。これまでの研究から、QhpCの複雑な構造は多段階の翻訳修飾によって作り出されていることが判明していました。さらに、今回の研究の成果として、QhpGは基質となるQhpCタンパク質に加え、架橋形成を行うラジカルSAM酵素のQhpDと3者複合体を形成していることがわかりました。その中で、QhpCの架橋形成反応が起きて、さらにシームレスに架橋QhpC中の特定のトリプトファン残基側鎖インドール環が二重に水酸化されることが明らかになりました(図1B)。インドール環の二重水酸化反応はCTQ形成反応の開始ステップであり、同様なキノン補酵素においても十分には解明されていなかった過程でした。本研究は、タンパク質中の特定のアミノ酸残基を二重に水酸化する反応を行う初めてのフラビン酵素の発見となりました。
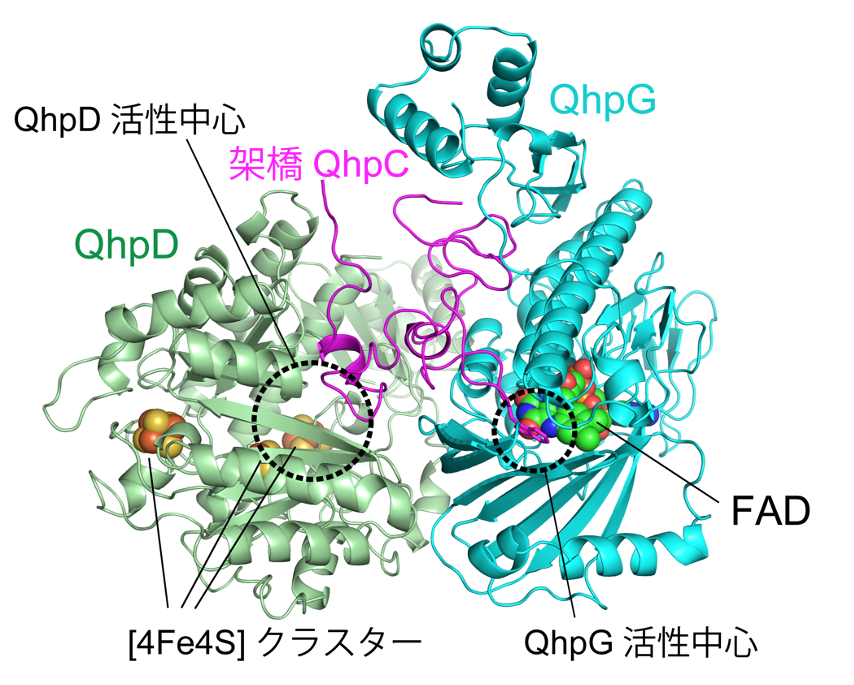
図2 QhpC/QhpD/QhpG3者複合体モデル。QhpDの[4Fe4S]鉄硫黄クラスター近傍の活性中心ポケットでQhpC中の3ヶ所の分子内架橋が形成されたのち、架橋されたQhpC中の特定のトリプトファン残基がQhpGのFAD近傍の活性中心において二重に水酸化されると推測されます。複合体形成によって、連続的かつ効率的な翻訳後修飾が可能となると考えられています。
本研究成果が社会に与える影響(本研究成果の意義)
自然界には各種の生理活性ペプチド(比較的少数のアミノ酸残基からなるタンパク質の一種)を作り出す類似性のある翻訳後修飾機構が複数存在し、QhpCの翻訳後修飾機構とも共通点があることが指摘されています。天然の生理活性ペプチドの生合成機構も参考にして、架橋ペプチドなど分子量2000ぐらいまでの中程度のサイズのタンパク質を基盤とする中分子創薬が、創薬の新しいトレンドとして注目されています。本研究成果により、QhpGを含むQhpCの翻訳後修飾機構が、新規なタンパク質修飾のツールとして、各種の生理活性ペプチドの開発に応用されることが期待されます。
特記事項
本研究成果は、2021年2月10日(水)19時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:Functional and structural characterization of a flavoprotein monooxygenase essential for biogenesis of tryptophylquinone cofactor
著者名:Toshinori Oozeki, Tadashi Nakai, Kazuki Kozakai, Kazuki Okamoto, Shun’ichi Kuroda, Kazuo Kobayashi, Katsuyuki Tanizawa and Toshihide Okajima
なお、本研究は、日本学術振興会科学研究費助成事業、および物質・デバイス領域共同研究拠点事業の支援を得て行われました。
分野の背景
生物の生命現象がどうようなしくみで起きるのかを、どんどん突き詰めていくと、最終的には、遺伝子DNAとタンパク質の働きが重要であることに突き当たります。遺伝子はタンパク質の設計図や制御にかかわる情報をDNAの塩基配列として保持している一方で、タンパク質の多くは化学反応を体内で効率よく実行する分子機械である酵素です。酵素はその設計図(遺伝子配列)がわかっていても、どのような形をしているのか、あるいはどのように働いているのかは、まだ十分にはわかっていません。私たちのグループの研究は、各種の酵素の形(構造)を決定し、その働き方を解明しています。このような酵素研究の重要性、応用性は、多岐にわたります。例えば、多くの医薬が酵素の機能を阻害する化学物質ですが、その医薬を作り出すことにも酵素を利用することが可能です。現在では、大腸菌に酵素の遺伝子(設計図)を入れて、自由に酵素を生産できるので、その構造機能の設計原理が解明できれば、役にたつ様々な酵素を作り出すことが可能となります。酵素はナノメートルサイズの小さな分子ですが、私たちの研究の進展は、医療、環境、エネルギーなどの大きなスケールの問題の解決にも貢献できるものと考えています。
参考URL
用語説明
- キノヘムプロテインアミン脱水素酵素(QHNDH)
各種のグラム陰性細菌のペリプラズムに存在する酵素であり、ヘテロ三量体からなるサブユニット構造をもっています。細菌が一級アミン類をエネルギー源、栄養源として利用するため、酸化的脱アミノ反応を触媒し、生じた電子を酵素分子内の2つのヘムを介して電子伝達系へと受け渡すことが明らかとなっています。
- 翻訳後修飾
遺伝子上にコードされたアミノ酸配列が翻訳され、タンパク質が合成された後に生じる各種のタンパク質修飾反応を意味しています。リン酸化などのように情報伝達に利用される場合もあれば、基本的な20種類のアミノ酸残基にはない新規な機能性を与える場合もあり、数多くのものが知られています。
- ビルトイン型補酵素
フラビン補酵素など補酵素の多くは、遊離の低分子として生合成された後、不活性なアポ酵素と結合し、活性型のホロ酵素となります。一方、いくつかの補酵素は、ポリペプチド鎖中にアミノ酸残基として組込まれた形で存在しており、ビルトイン型補酵素と呼ばれています。遺伝子上では、通常のアミノ酸残基(もしくは終止コドン)としてコードされており、翻訳後修飾や特殊なタンパク質翻訳機構によって作り出されることが判明しています。
- チオエーテル架橋構造
QhpCタンパク質中の3ヶ所では、システイン残基側鎖と酸性アミノ酸残基側鎖メチレン基との間に、硫黄―炭素原子の共有結合が形成されます。一般的なタンパク質内架橋構造であるジスルフィド結合に比べて、化学的に非常に安定であり、金属触媒を用いた強力な還元剤を用いないと切断することができません。ラジカルSAM酵素QhpDによって形成されることが判明しています。
- ラジカルSAM酵素
複数の鉄硫黄クラスター含有する酵素ファミリーであり、S-アデノシルメチオニン(SAM)を分解して生じたラジカルによって、架橋形成や硫黄原子の挿入など有機化学的に困難な反応を触媒します。
