疎水性パッキングがゆるくても折り畳み能を示し超安定な人工タンパク質
発表のポイント
・これまでに創製された人工タンパク質は変性温度が100°C以上と超安定
・人工タンパク質の安定性の仕組みを解明すれば、耐熱性タンパク質創出への道が拓ける
・局所および非局所 両方について多くの相互作用を形成している"ハブ"残基が安定性に大きく寄与していることが明らかになった
・タンパク質構造内部を形成する疎水性アミノ酸残基の大半をサイズの小さい残基(バリン)に置換し、疎水性パッキングをゆるめても、置換前と同様の構造に折り畳み、100°C以上の熱安定性を示すことが明らかになった
・人工タンパク質の高い熱安定性は、疎水性アミノ酸残基による側鎖パッキングというよりも、主鎖構造に起因することが示された
・自然界のタンパク質の耐熱化および新規機能性タンパク質創出のための土台となる安定な構造の創製に貢献できると期待される
概要
分子科学研究所協奏分子システム研究センター/生命創成探究センター生命分子創成研究グループの古賀理恵特任研究員、山本真実大学院生(総合研究大学院大学、当時)、小杉貴洋助教、古賀信康准教授、理化学研究所放射光科学研究センターの小林直宏上級研究員(大阪大学蛋白質研究所、以前)、大阪大学蛋白質研究所の杉木俊彦特任助教(常勤)、藤原敏道教授の研究グループは、これまでに設計した人工タンパク質が構造内部の強固な疎水性パッキングを失っても、折り畳み能と高い熱安定性を有していることを発見しました。これまでに研究グループは、タンパク質設計原理をもとに、多くのタンパク質の人工設計に成功しています。これら人工タンパク質は、望みの3次構造 へと折り畳みやすいように、局所主鎖構造(2次構造 の長さやループの形状)が設計され、加えて、タンパク質内部は疎水性アミノ酸残基がジグソーパズルのように密にパッキングするように設計されていました。しかしながら研究グループは、パッキングを形成する疎水性アミノ酸をほぼ全て、サイズの小さい疎水性アミノ酸(バリン)に変えても、人工タンパク質は折り畳み能を示し、さらに、その変性温度は100°C以上と非常に高いことを明らかにしました。この結果は、疎水性アミノ酸残基による側鎖パッキングというよりも、2次構造の長さやループの形状といった局所主鎖構造が人工タンパク質の折り畳み能と高い熱安定性において重要であることを示唆しています。従来、タンパク質の耐熱化は、アミノ酸置換による側鎖構造の改変によって行われてきましたが、本研究成果により、主鎖構造を改変することで自然界のタンパク質を耐熱化できる可能性が期待されます。また、新規機能性タンパク質創出のための土台となる安定な構造を創製する技術開発にも貢献すると期待されます。
本研究成果は、学術誌「Proceedings of the National Academy of Sciences of the United States of America」に2020年11月24日午前5時(日本時間)以降にオンライン掲載されました。
研究の背景
タンパク質の構造デザインは、近年、飛躍的な発展を遂げています。その発展を支えたのは、研究グループの発見した「ある局所主鎖構造(2次構造 の長さやループの形状)を形成したときの、形成しやすい3次構造 に関するルール」です。研究グループは、望みの3次構造を人工設計する際に、その3次構造に最適な局所主鎖構造を、そのルールを用いて設計することで、様々なタンパク質構造の創出に成功してきました。興味深いことに、これら設計したタンパク質は自然界のタンパク質とは異なり、100°Cでも変性しないという特性を有していました。しかしながら、なぜこれらタンパク質が極めて高い熱安定性を示すのか、その機構は明らかではありませんでした。
これまでの長年にわたるタンパク質の折り畳み研究から、タンパク質の安定性には、タンパク質内部のジグソーパズルのように密な疎水性アミノ酸残基の側鎖パッキングが重要であると示唆されています。実際、研究グループがデザインしたタンパク質にも、このようなパッキングが設計されています。しかしながら一方で、研究グループの用いたルールは、疎水性パッキングというよりも、局所主鎖構造の重要性を示唆しています。そこで研究グループは、人工タンパク質の安定性の起源は、タンパク質内部の疎水性パッキングによるものなのか、もしくはルールにより設計した局所主鎖構造によるものなのか、これらを明らかにすることを目的として研究を行いました。
研究の成果
研究グループは、これまでに設計した人工タンパク質のうち、最も高い熱安定性(変性温度~130°C)を示す人工タンパク質に着目し、このタンパク質内部の、ロイシン(L)およびイソロイシン(I)残基を、よりサイズの小さいバリン残基(V) に置換し、疎水性パッキングを壊したときの安定性の変化を、円偏光二色性 を用いて調べました。まず、ロイシンとイソロイシン10残基を各々バリンに置換した10個の変異体を作製し、これらの熱安定性を測定したところ (図1) 、配列に沿って遠い残基と近い残基の両方と相互作用しているハブのような疎水性残基( 図1 の赤やオレンジ)が安定性に大きく貢献していることが明らかになりました。
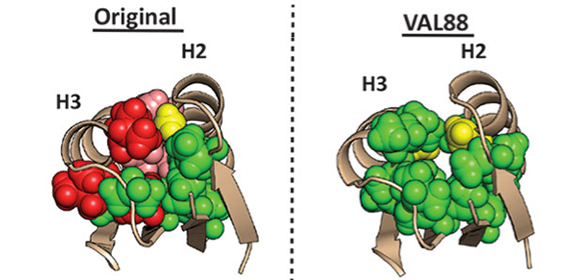
さらに、これら10個のロイシン、イソロイシン全てをバリンに置換した、タンパク質内部のほとんど(88%)がバリンからなる人工タンパク質VAL88を作製し、性質を調べたところ (図2) 、疎水性パッキングが大きく失われている( 図2E )にもかかわらず、100°C以上の安定性( 図2A )を示し、核磁気共鳴分光法 による構造決定を行ったところ、変異前と同様の構造へと折り畳むことが明らかになりました( (図2B, C, D )。このことから、人工タンパク質の高い熱安定性は、疎水性残基の密な側鎖パッキングというよりむしろ、局所主鎖構造に起因していることが示唆されました。
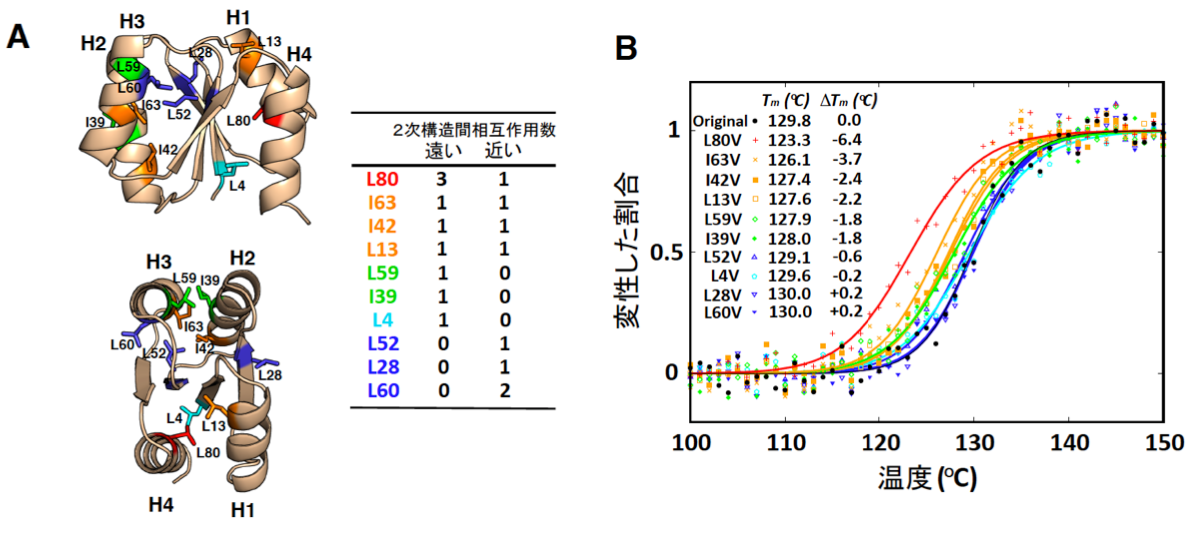
図1 "ハブ"残基が安定性に大きく寄与
(A) これまでに設計した人工タンパク質のうち最も高い熱安定性を示す人工タンパク質に含まれるロイシン残基(L)およびイソロイシン残基(I)の位置。L, Iに続く数字は残基番号を表す。人工タンパク質を側面(上図)および上(下図)から見た構造を示す。赤やオレンジで示す残基が、配列に沿って遠い残基と近い残基の両方と相互作用するハブ残基。
(B) バリン残基(V)に置換したときの熱安定性の変化。黒で示したのが変異前のオリジナルの人工タンパク質の熱変性曲線。ハブ残基を変異した場合に、大きな熱安定性の低下(S字カーブが左側にシフト)が見られる。
今後の展開・この研究の社会的意義
自然界に存在するタンパク質のバイオマテリアル利用、酵素タンパク質の産業利用等においてタンパク質の耐熱化は大きな課題です。本研究で示された人工タンパク質の安定化の機構はタンパク質の耐熱化手法の1つとして役立つことが期待されます。また、生命現象の制御・設計、医療等への貢献に向けた新規機能性タンパク質の創出において、機能設計の土台となる構造をいかに安定に設計するかは重要な課題です。本研究で得られた知見は、新規機能性タンパク質の創出にも大きく貢献するものです。

図2 タンパク質内部のほとんどがバリンからなる人工タンパク質(VAL88)
(A) 熱変性における円偏光二色性 スペクトルの変化。青色のカーブは、30°Cでタンパク質がαヘリックスとβシートからなる2次構造を形成していることを示す。このカーブの形状と強度が、温度を上昇させると(緑、黄、赤色のカーブに移行するにつれ)変化していき、これは2次構造が温度の上昇に伴い壊れることを示す。タンパク質の折り畳みを2次構造形成割合で観測したとすると、折り畳んだ状態とほどけた状態にあるタンパク質の数が等しいときの温度を変性温度とよび、VAL88は106.1°Cである。
(B) 核磁気共鳴分光法 により解かれたVAL88の構造。
(C) VAL88構造内部。緑で示したのがバリン残基。構造を側面(左図)および上(右図)から見た図。
(D) オリジナルとVAL88構造の疎水性パッキングを比較したもの。(C)の右図と同様に構造を上から見ている。
(E) 下図に示すタンパク質内部の疎水性残基(6残基)の重水素交換 の速度を示した図。重水素に交換されるとシグナルが減少する。VAL88(破線)の方がオリジナル(実線)に比べて早くシグナルが減少しており、タンパク質内部のパッキングがゆるいことを示す。
論文情報
掲載誌:Proceedings of the National Academy of Sciences of the United States of America
論文タイトル:"Robust folding of a de novo designed ideal protein even with most of thecore mutated to valine"(「コアの大半がバリンに置換されても新規理想デザインタンパク質が示す頑強な折り畳み」)
著者:Rie Koga, Mami Yamamoto, Takahiro Kosugi, Naohiro Kobayashi, Toshihiko Sugiki, Toshimichi Fujiwara, and Nobuyasu Koga
掲載日時:2020年11月24日午前5時(日本時間)以降にオンライン公開
DOI: 10.1073/pnas.2002120117
研究グループ
分子科学研究所
生命創成探究センター
大阪大学蛋白質研究所
理化学研究所
研究サポート
日本医療研究開発機構(AMED) 創薬等ライフサイエンス研究支援基盤事業(BINDS) JP19am0101072
科研費・若手研究(A) 15H05592(古賀信康)
科研費・基盤研究(C) 18K06152(小林直宏)
新学術・発動分子科学 18H05420(古賀信康、小杉貴洋)
科学技術振興機構 さきがけ JPMJPR13AD(古賀信康)
参考URL
蛋白質研究所 藤原研究室HP
http://www.protein.osaka-u.ac.jp/biophys/bussei.html
用語説明
- 局所および非局所
タンパク質のアミノ酸配列の並びにおいて、ある残基から近い残基を局所、遠い残基を非局所と呼ぶ。
- 3次構造
(タンパク質の階層構造):
タンパク質は1次から4次の階層構造を持つ。1次構造はアミノ酸の配列、2次構造は連結されたアミノ酸残基の主鎖間の規則的な水素結合で形成される局所的な構造(αヘリックス、βシートなど)、3次構造はこれら2次構造が側鎖間のパッキング等の非共有結合的な相互作用で形成される構造、4次構造は複数のタンパク質分子が集まって形成される構造である。
- 2次構造
タンパク質は1次から4次の階層構造を持つ。2次構造は連結されたアミノ酸残基の主鎖間の規則的な水素結合で形成される局所的な構造(αヘリックス、βシートなど)である。
- ロイシン(L)およびイソロイシン(I)
脂肪族側鎖を持つ疎水性残基。 ロイシン、イソロイシンの側鎖は炭素を4個持つ。
- バリン残基(V)
脂肪族側鎖を持つ疎水性残基。ロイシン、イソロイシンの側鎖が炭素を4個持つのに対し、バリンは炭素を3個持つ。
- 円偏光二色性
タンパク質に左右円偏光を照射し遠紫外領域でその吸光度の差を観測することにより、タンパク質のヘリックス、ストランド、コイルといった2次構造形成能がわかる。温度を変えながら測定することにより、タンパク質の熱変性を観測する。
- 核磁気共鳴分光法
タンパク質を磁場中に置きラジオ波を照射することで生じる核スピンの共鳴現象を観測することにより、タンパク質の分子構造を原子レベルで解析することができる。
- 重水素交換
タンパク質を重水に溶かしたときに、主鎖のアミド基の水素が重水素に交換されていく速度を観測する。タンパク質内部で密にパッキングしている残基ほど、重水素に交換されにくい。
