ダウン症研究に新展開!合併症の新たな治療法開発に光
ヒトiPS細胞とゲノム編集技術を駆使、頻発する合併症のメカニズムを明らかに
本研究成果のポイント
・ヒトiPS細胞でゲノム編集 と呼ばれる新しい遺伝子操作技術を駆使しダウン症候群の疾患モデルを確立
・同症新生児10%以上で見られる合併症の一過性骨髄異常増殖症(TAM) の発症メカニズムを明らかにし、その原因領域および責任遺伝子の同定に成功
・ダウン症候群で頻発する白血病の診断・治療法の確立や、ダウン症の多様な合併症の病態の診断・治療法開発の進展に期待
リリース概要
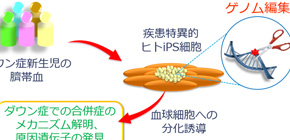
大阪大学大学院医学系研究科情報統合医学講座(小児科学)の大薗恵一教授、北畠康司助教らのグループは、ヒトiPS細胞にゲノム編集技術および染色体工学を組み合わせることで、ダウン症候群の多様かつ詳細な疾患モデル細胞 を樹立し、同症の新生児に高頻度で発症する一過性骨髄異常増殖症(Transient abnormal myelopoiesis:TAM)の病態メカニズムを明らかにするとともに、21番染色体上の病態責任領域および主要遺伝子の同定に成功しました。
ダウン症候群は21番染色体の数が2本から3本に増えることで発症します。そのため単一遺伝子疾患とは異なり、数百個以上の遺伝子の量的変化が同時に起こります。病態の本質を理解するためには21番染色体上の330個もの遺伝子のうち、どの、そしていくつの、遺伝子変化の組み合わせが病態に関与しているのかを知ることが重要ですが、膨大な組み合わせの解析を必要とするため非常に困難でした。本研究では、新しい遺伝子操作技術として近年注目を集めているゲノム編集技術をヒトiPS細胞において駆使することによって、造血異常をもたらす‘ダウン症候群重要領域(Down Syndrome Critical Region)’を同定し、さらにその中にある主要遺伝子群を明らかにしました (図1) 。
本研究成果は、ダウン症候群で頻発する白血病の診断・治療法の確立につながると期待されるだけでなく、精神発達障害や認知機能異常など同症で見られる多様な病態研究の新たな手法を提示するものであり、今後のダウン症研究を発展させるきっかけになると考えられます。
本研究成果は、2016年4月28日(木)正午(米国東部時間)、米国の科学誌「Cell Reports」に掲載されました。

図1 ヒトiPS細胞とゲノム編集技術をもちいたダウン症候群の病態解析
臍帯血は(母親でなく)新生児と同一の遺伝子構造をもっています。この臍帯血を用いることで、新生児に侵襲を与えることなく、しかも高効率にiPS細胞を作成することが可能であることが分かりました。樹立したダウン症iPS細胞に、ゲノム編集技術にもちいて様々な遺伝子改変を行い、さらに血球細胞へと分化誘導することで、ダウン症に頻発する造血異常・白血病の発症メカニズムの解明を行うことが可能となりました。
研究の背景
ダウン症候群は700人に1人という小児遺伝性疾患で最も多い頻度で見られ、近年その数はさらに増えつつあります。心奇形・精神発達異常など多彩な合併症が見られますが、とりわけ特徴的なのが新生児期に高い頻度で見られる血液細胞の増殖異常(通称TAM)です。21番染色体のトリソミー(染色体数が3本に増えること)に加えて、X染色体上にあるGATA1遺伝子 の変異が関与していると考えられていますが、それらがどのような相互作用で異常をもたらしているのか、21番上のどの遺伝子群が関わっているのかなどについてはよく分かっていませんでした。
こういった不明事項を解明し、研究を発展させるには正確で使いやすい実験モデル細胞/動物の存在が不可欠ですが、ダウン症の実験モデル系を作ることは長いあいだ困難でした。それは細胞に染色体を一本まるごと挿入することは容易でなく、また研究に一般的によく用いられるマウスでは、染色体を構成する遺伝子の組み合わせがヒトと異なるためです。しかしiPS細胞技術の発明と、さまざまな細胞・動物種における遺伝子操作を可能にする‘ゲノム編集技術’の開発により、正確でさまざまな情報を得ることのできる疾患モデル系を作り出すことが可能になりました。
研究の成果
本研究では、まず健常児・ダウン症児(TAM発症あり/なし)の臍帯血から作成したiPS細胞をもとに、GATA1遺伝子に様々なゲノム編集を行うことによって、染色体・遺伝子型の組み合わせによって異なる20種類、40株以上のiPS細胞を作成し、TAMの病態を再現することに成功しました (図2A) 。その結果、21番染色体のトリソミーと遺伝子変異をもったGATA1には以下のような作用があることが分かりました。
・21番染色体トリソミー:過剰に血球増殖を亢進する
・GATA1変異:血球(とくに巨核芽球系 )の血球分化を乱す
一方、21番染色体上には造血異常に伴って発現量が大きく変化する遺伝子群が存在し、それらは4Mb という限られた領域に集まっていることもわかりました。そこでこの4Mbの領域が染色体1本分からのみ除去された‘部分トリソミーiPS細胞’の作成に取り組みました (図2B) 。ヒト細胞で4Mbという大きな染色体領域を除去するのは非常に難しいのですが、ゲノム編集技術と遺伝子情報解析、染色体工学を組み合わせることでその樹立に成功しました。この部分トリソミーiPS細胞は、予想通り、造血異常という特徴を失っていることから、この4Mb領域がダウン症における造血異常の責任領域であることが分かりました。
図2 疾患特異的ヒトiPS細胞とゲノム編集技術をもちいたダウン症候群の病態モデルの確立
(A)まず健常児、ダウン症児(TAM発症あり/なし)の臍帯血からiPS細胞を作成しました。これをもとにゲノム編集を行い、GATA1遺伝子に様々な変異を導入しました。
(B)ダウン症iPS細胞を造血系へと分化誘導させると、とくに発現量の高い遺伝子群が存在し(左下)、それらは21番染色体上の4Mbの領域にクラスターを作っていることが分かりました。このRUNX1とETS2に挟まれた4Mb領域を、1染色体分だけ欠失させた部分トリソミーiPS細胞を作成することができ(右上)、そしてそれらが(造血異常という)病態を失っていたのならば、この領域がダウン症における造血異常の病態責任領域といえます。
本研究グループはさらに解析を進め、この4Mb領域の作用によって変異型GATA1の発現量がさらに増加することを見いだし、21トリソミーとGATA1遺伝子変異のあいだの重要な相互作用を明らかにしました (図3) 。またこの4Mb領域に位置している遺伝子群のうちRUNX1とETS2がとくに重要な役割を担っていることも分かりました。
本研究成果が社会に与える影響(本研究成果の意義)
ダウン症候群は、最初の報告から今年でちょうど150年という古くからよく知られた疾患ですが、近年妊娠女性の高齢化、新生児医療の発達による生存率の向上、ダウン症候群患者の平均寿命の高齢化など、同症をとりまく社会的環境は大きく変化しています。数百個以上の遺伝子が関与するその病態を明らかにし、治療法の開発を行うことは急務です。
本研究成果により、ダウン症候群における一過性骨髄異常増殖症の発症機序が明らかになっただけでなく、白血病へと至る多段階発症メカニズムを知るきっかけになると考えられます。さらにヒトiPS細胞とゲノム編集技術を戦略的に組み合わせることで、造血異常だけでなくその多様な合併症の病態を明らかにすることが可能になると思われ、今後診断・治療法の開発が大きく進むと期待されます。

図3 21トリソミーとGATA1変異の相互作用による造血異常の発症メカニズム
21番染色体のトリソミーには、血管内皮細胞から血球が作られる最初のステップを刺激し、造血を亢進させる作用があります。一方GATA1変異は、異常な巨核芽球の産生など血球分化の異常を引き起こします。さらに21トリソミーの4Mb領域が変異GATA1の発現を亢進させ、これらの相互作用によってTAMの病態が形作されることが分かりました。
特記事項
本研究成果は、2016年4月28日(木)正午(米国東部時間)、米国の科学誌「Cell Reports」に掲載されました。
<論文タイトル>
Systematic cellular disease models reveal synergistic interactions of trisomy 21 and GATA1 mutations in hematopoietic abnormalities
<著者>
坂野公彦、大森早也佳、平田克弥、那波伸敏、中川夏季、西村健、大高真奈美、中西真人、佐久間哲史、山本卓、土岐力、伊藤悦朗、山本俊至、國府力、竹田潤二、谷口英俊、荒堀仁美、和田和子、北畠康司、大薗恵一
<掲載誌>Cell Reports (2016) (in press)
<研究支援>
本研究は、主に科学技術振興機構さきがけ‘iPS細胞と生命機能’領域採択課題「染色体異常症候群における合併症の発症メカニズムの解明」の支援により行われました。
参考URL
大阪大学大学院医学系研究科情報統合医学講座(小児科学)HP
http://www.med.osaka-u.ac.jp/~ped/www/Welcome-jp.html
用語説明
- ゲノム編集
さまざまな細胞・動物種における遺伝子改変を可能にする新しい技術です。これまでの技術ではできなかったような遺伝子操作を、高い効率で行うことが可能となりました。Zinc Finger Nuclease、TALE Nuclease(TALEN)がまず開発されましたが、最近はCRISPR/Cas9システムが広く使われています。いずれの技術においても、狙った遺伝子配列に効率よくDNA二本鎖切断を導入することが重要で、その切断部位に対して細胞が修復しようとする機構を利用して遺伝子変異導入・外来配列の挿入・置換などを行います。
- 一過性骨髄異常増殖症(TAM)
ダウン症候群の新生児期に、末梢血液細胞の異常増殖が見られる疾患です。ダウン症新生児の10%以上に見られ、多くは自然に寛解するものの、その約30%が数年以内に白血病を発症します。その病態にはGATA1遺伝子の短縮型変異が重要な働きを果たすと言われています。
- 疾患モデル細胞
ある病気の研究を行うには、まずその病態を再現することが重要です。原因となる遺伝子異常が分かっている場合は、同一の遺伝子異常をもつ細胞あるいは動物を作成し、その遺伝子変化がどのようにして病態を引き起こすのかを一つずつ調べる必要があります。この疾患を再現できる細胞を疾患モデル細胞と呼びます。
- GATA1遺伝子
X染色体上にコードされる遺伝子で、血液細胞分化、とくに赤芽球・巨核芽球分化に重要な働きを果たします。TAMにおいては、このGATA1がなくなる(欠失する)のではなく、(N末端側だけを失った)短縮型変異が起こることが必要とされています。
- 巨核芽球
血液細胞は造血幹細胞がさまざまな系列の細胞に分化することで作られます。血小板は、造血幹細胞から巨核芽球と呼ばれる未熟な段階を経て巨核球となり、そこから作られます。同様に赤血球は赤芽球、白血球は骨髄球と呼ばれる未熟な細胞の過程を経て作られます。
- 4Mb
DNAは塩基の結合から成りますが、ひとつの単位を塩基対(ベースペア、略してbp)と言い、長さの単位にもなります。たとえばヒトゲノムは約3Gbp(ギガベースペア、30億塩基対)です。私たちが見つけた21番染色体上の造血異常の重要領域は、4Mb(メガベースペア)、つまり400万塩基対の長さの領域にわたって存在しています。
- RUNX1とETS2
いずれも21番染色体上にコードされる遺伝子で、造血系の分化に重要な働きをしていると考えられています。
