染色体の大規模構造変異を高精度に検出できるアルゴリズムを開発
細胞のがん化の原因究明とがんの早期発見につながることへ期待
本研究成果のポイント
・超並列DNAシーケンサーで得られる正常およびがん細胞ゲノム配列のビッグデータを高速・高精度に比較
・がん化した組織中のがん細胞の比率が低くても、がん細胞中の構造変異を高精度に検出可能
・がん細胞に特有のDNA変化を早期に検出し、的確な治療法を選択することが可能になることを期待
概要
国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という) 創薬基盤研究部門【研究部門長 織田 雅直】 ゲノム機能情報研究グループ 瀬々 潤 主任研究員、山形 浩一 元産総研特別研究員(現 中央大学 助教)と国立大学法人 大阪大学【総長 西尾 章治郎】(以下「大阪大学」という) 大学院 医学系研究科 竹田 潤二 教授らのグループは、大規模な染色体異常(構造変異 )を高精度・高感度に検出できるアルゴリズムを搭載したソフトウエアCOSMOS を開発しました。
近年、がん化した細胞に特徴的な構造変異が頻繁に観測されており、この構造変異を高精度・高感度に検出することが、細胞のがん化の早期発見と、構造変化の解析結果をもとにした的確な治療法の選択につながると期待されています。今回開発したCOSMOSは、超並列シーケンサー から得られたゲノム配列のビッグデータを高速に解析できるソフトウエアで、マウスES細胞などを用いて検証したところ、既存手法を大幅に上回る精度や感度を実現していました。この技術は、細胞のがん化の原因究明やがんの早期発見の実現への貢献が期待できます。
なお、この技術の詳細はNucleic Acids Researchに掲載されますが、それに先立ち、オンライン版が2016年2月2日2:00(日本時間)に掲載されました。
( http://dx.doi.org/10.1093/nar/gkw026 )
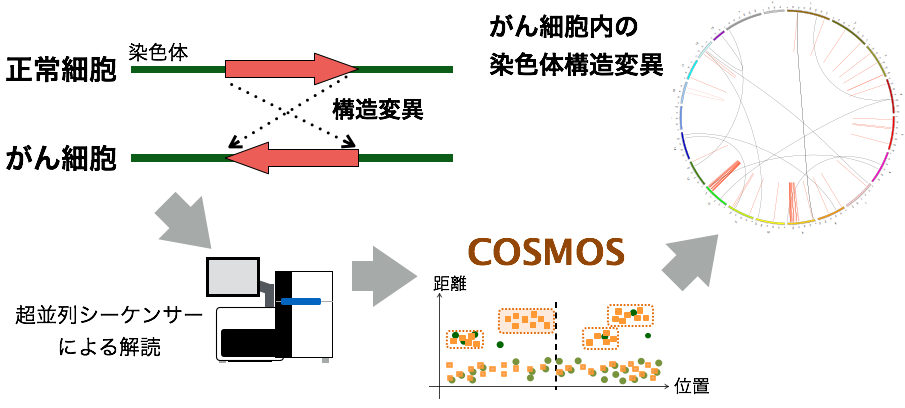
構造変異検出ソフトウエアCOSMOSの概要
正常細胞とがん細胞から超並列シーケンサーを用いて得た配列を解析して、がん化した細胞で起こった構造変異を網羅的に同定する。
開発の社会的背景
近年、がん化した細胞では、そのゲノム配列に大きな変化(構造変異)が頻発することが明らかになってきています。この変化を高精度で詳細に検出することで、がん化の早期発見と、がん化パターンの特定が可能になり、 適切ながん治療や創薬につながると期待されています。しかし、これまでの構造変異を検出する技術は、感度や精度が必ずしも高くないため、実用化に向け改善が望まれていました。
研究の経緯
産総研は、ゲノム配列ビッグデータを高速・高精度に解析する情報・統計技術を持っています。また、大阪大学 竹田研究室では、マウスのES細胞等を用いた遺伝子編集技術を持ち、ヒトの病態や遺伝子を理解する技術の開発に取り組んできました。今回、産総研の解析技術と大阪大学の遺伝子変異を導入する技術を組み合わせて、染色体の構造変異の高性能な検出技術の開発を目指すこととしました。
なお、本研究開発は、独立行政法人 日本学術振興会の科学研究費助成事業 新学術領域研究(研究領域提案型)の研究課題「ゲノムアダプテーションのシステム的理解」(2013~2014年度)や、文部科学省科学研究費新学術領域研究「生命科学系第3分野支援活動」ゲノム支援(2013年度~)などの支援を受けて行いました。
研究の内容
今回開発したCOSMOSは、超並列シーケンサーを用いて読み取った全ゲノム情報をもとに、細胞ががん化する際にどのような構造変異が染色体上に起こったかを精度よく検出するソフトウエアです。超並列シーケンサーを用いることで、細胞の全ゲノム情報は比較的容易に得られるようになりつつあるが、得られる配列は断片的なものであるため、がん化時に起こった変化を知るには、それを解析するための計算機アルゴリズムや統計技術が必要となります。また、がん化した細胞の解析では、摘出される組織内にはがん化した細胞と正常細胞が混在しているため、これらの違いを明確にし、感度よくがん化時に起こった変化を知る技術が必要です。
COSMOSでは、超並列シーケンサーを用いて正常細胞とがん細胞のそれぞれから得た配列を、非対称比較法と向き付き深度情報 を組み合わせて解析し、従来法に比べて高い精度と感度を実現しました (図1) 。 従来の構造変異検出法では、がん細胞と正常細胞から別々に構造変異を検出し、その差分を調べます。それに対し、COSMOSで用いている非対称比較法では、がん細胞からは構造変異を検出しますが、正常細胞からは検出を行いません。代わりに正常細胞からは異常配列の現れやすさだけを計算し、その結果をもとに、解析を行います。
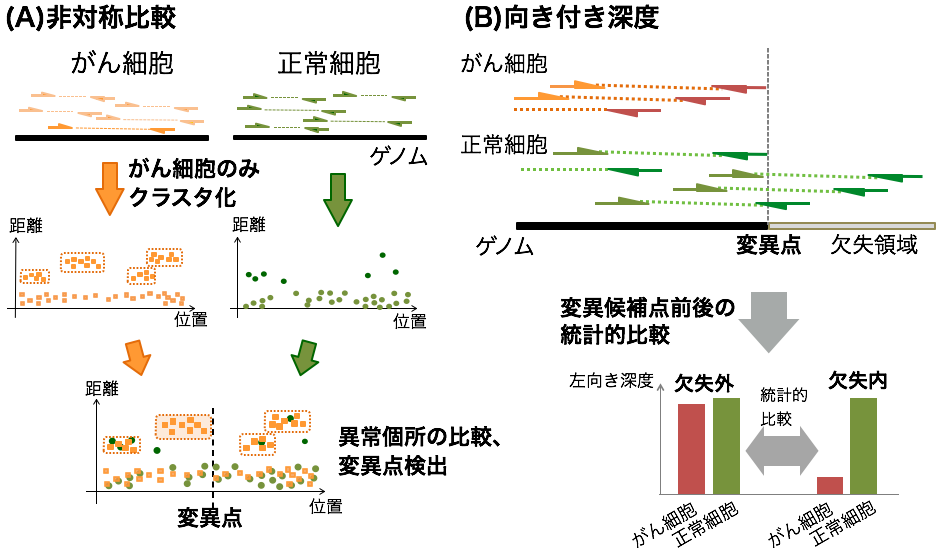
図1 COSMOSのアルゴリズムに導入した非対称比較法(A)と向き付き深度(B)
COSMOSは、特に、採取した組織内のがん細胞の割合が低い場合でも、既存の手法より高い精度で正確な検出ができる (図2(A)) 。例えば、がん細胞が全体の10~20 %程度であっても、高精度に構造変異を検出できる。更に、マウスES細胞を用いて、COSMOSと既存手法で検出された構造変異について、その変異が実際に起こっているかどうかをPCR法 とサンガー法 による実験的な配列解析によって検証した。その結果、COSMOSでは構造変異を正しく検出できた割合が84.5 %であり、既存手法での割合である70.4%よりも14%上回っていた (図2(B))。
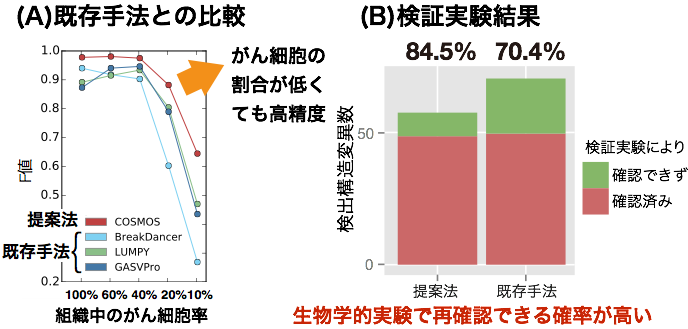
図2 構造変異検出法の精度の比較。(A)がん細胞の割合を擬似的に変化させた際の精度変化、(B)マウスES細胞を用いた実験による、精度の検証
F値は、精度と感度の調和平均(2×精度×感度/(精度+感度))であり、値が大きいほど性能が高いことを示す。
今後の予定
今回開発した手法は全ゲノム解析を対象としています。一方、費用面の安さから遺伝子領域だけを超並列シーケンサーで読む技術のニーズも高いため、それらの技術への対応を目指します。既存手法に比べ精度向上が認められるが、がん細胞の割合が低い場合には検出感度が落ちる傾向にあるため、アルゴリズムの改善や実験手法の見直しにより検出感度の向上を目指します。また、ヒトの患者由来のゲノム配列による検証実験を進めることで、精度向上を図ります。これにより、細胞のがん化に関する生物学的理解を深め、ゲノム配列の変化を基にしたがん治療法の選択への貢献を目指します。
参考URL
大阪大学大学院医学系研究科 ゲノム生物学講座(環境・生体機能学)HP
http://www.med.osaka-u.ac.jp/pub/mr-envi/www/index.html
用語説明
- 構造変異
(染色体)構造変異:
染色体中に数百塩基から数百万塩基にわたる大規模な変化を伴う変異。主なものとして、既存配列の欠失(Deletion)・逆位(Inversion)・重複(Duplication)、新規配列の挿入(Insertion)、染色体を超えた転座(Translocation)などが挙げられる。
- COSMOS
今回開発した、染色体の大規模構造変異を検出するソフトウエア。正式名称はCOntrol SaMple-based detectiOn of Structural variation。COSMOSは、ウェブサイト【 http://seselab.org/cosmos/ 】で公開している。
- 超並列シーケンサー
超並列(DNA)シーケンサー:
大規模で網羅的なゲノム配列解析を超並列化することで、高速に行う装置。次世代シーケンサーの一つであり、全ゲノム配列の解読や、遺伝子の発現量解析に用いられる。
- 向き付き深度情報
深度情報とは、ゲノム上のある場所のゲノムが、何回読まれたかを示す値である。通常、シーケンサーで読まれた配列全てを用いて、この値を計算する。向き付き深度情報は、読まれた配列には、染色体の左から右に読んだ配列と、右から左に向かって読んだ配列があることを考慮し、右向きのみ、あるいは、左向きのみの配列の情報だけを利用した深度情報である。
- PCR法
目的とする染色体領域を特異的に増幅する手法。
- サンガー法
DNAシーケンサーによるDNAの配列解析の方法の一つ。超並列シーケンサーが普及する以前から利用されている。
