世界に先駆け発見! 神経細胞の個性化と精緻な回路形成に必要な発生初期のDNA修飾メカニズムを解明
リリース概要
大阪大学大学院生命機能研究科の豊田峻輔特任研究員と八木健教授らは、発生初期のDNA修飾が個々の神経細胞の個性化と正常な樹状突起のパターン形成に関わっていることを発見しました。
長年、神経細胞は生後の神経活動に依存して精緻な回路網を形成すると考えられてきましたが、本研究では発生初期のエピジェネティック制御が神経細胞の個性化や回路形成に重要であり、Dnmt3bがそのキーとなる制御因子であることを世界に先駆けて発見しました。その方法は、胎生致死になるDNA修飾酵素欠損マウスから人工多能性幹細胞(iPS細胞)を樹立し、キメラマウスを作製する新たな方法を開発し、証明することに成功しました。本研究により、神経細胞の個性化と回路形成の新たな分子メカニズムが明らかになり、またDNA修飾の異常により引き起こされるヒトの遺伝病や精神疾患の原因解明に貢献することが期待されます。
本研究は、東京大学医科学研究所の中内啓光教授らの研究グループ、自然科学研究機構生理学研究所の吉村由美子教授・平林真澄准教授らの研究グループ、理化学研究所発生・再生科学総合研究センターの岡野正樹チームリーダーらの研究グループとの共同研究にて行いました。
本研究成果は、平成26年4月2日正午(米国東部時間)に米国科学誌「Neuron」のオンライン速報版で公開されます。
研究の背景
脳は多数の神経細胞によって複雑な回路網を形成し、高度な情報処理を行っています。近年、生理学的な解析などにより、個々の神経細胞は独自の回路特性を持ち、個性的な振る舞いをしていることが明らかになってきています。しかしながら、神経細胞の個性化や局所回路形成における分子メカニズムの多くは未だ謎のままでした。
クラスター型プロトカドヘリン分子群(cPcdh) は58種の多様化した膜タンパク質で構成されており、個々の神経細胞ごとに異なるcPcdh遺伝子がランダムに発現していることから、神経細胞の個性化に関わっていると考えられています (図1) 。以前の研究により、各cPcdh遺伝子は独自のプロモーターを持っており (図1) 、培養細胞株において遺伝子発現とプロモーター領域のDNAメチル化 状態が相関していることが報告されていましたが、生体内におけるメカニズムは明らかになっておりませんでした。
本研究の内容
本研究グループは、生体内におけるcPcdh遺伝子群のDNAメチル化制御メカニズムの解析を行いました。その結果、主な神経細胞の産生が見られる以前のマウス胎生3日目から9日目にかけて、メチル基転移酵素Dnmt3bが細胞ごとに異なるメチル化パターンを形成することを見出だしました (図2) 。Dnmt3b欠損マウスは胎生致死となるため、Dnmt3b欠損マウスからiPS細胞 を樹立し、野生型の胚に注入することでキメラマウスを作製しました (図3) 。これらのマウスは生後も生きており、脳ではDnmt3b欠損の神経細胞(緑色蛍光タンパク質GFPで標識)が観察されました。小脳にあるプルキンエ細胞 の形態を詳細に解析したところ、野生型細胞に比べDnmt3b欠損細胞では樹状突起の重なりや束が多く認められ、Dnmt3bが樹状突起のパターン形成に必須であることが分かりました (図3) 。そこで次に個々のプルキンエ細胞におけるcPcdh遺伝子群の発現を解析するために、キメラマウスの小脳の細胞を分散し、細胞の形態を指標にプルキンエ細胞をピックアップして、集積微小流体回路を用いた遺伝子発現解析を行いました。その結果、野生型のプルキンエ細胞では細胞ごとに異なるcPcdh遺伝子がランダムに発現していたのに対し、個々のDnmt3b欠損プルキンエ細胞ではcPcdh遺伝子の発現確率が増大し、すべてのcPcdh遺伝子を発現している細胞も観察されました (図4) 。cPcdh遺伝子は特異的なエンハンサーによって選択されて発現されることが知られています。本研究により、発生初期のDnmt3b依存的なDNAメチル化は個々の神経細胞におけるエンハンサー依存的なcPcdh遺伝子群のランダムな発現を制御し、神経細胞の個性化や精緻な回路形成に重要であることが明らかになりました (図5) 。
本研究成果が社会に与える影響(本研究成果の意義)
長年、神経細胞は生後の神経活動に依存して精緻な回路網を形成すると考えられてきましたが、本研究では発生初期のエピジェネティック制御が神経細胞の個性化や回路形成に重要であり、Dnmt3bがそのキーとなる制御因子であることを世界に先駆けて発見しました。本研究の知見は、こころの生得性と獲得性を考える上でも重要であり、Dnmt3b変異によるヒト遺伝病ICF(免疫不全、セントロメア不安定性、顔貌異常)症候群や精神疾患の解明に貢献することが期待されます。
特記事項
本成果は、戦略的創造研究推進事業チーム型研究(CREST)「脳神経回路の形成・動作原理の解明と制御技術の創出」(研究総括:小澤瀞司、研究代表者:八木健)、新学術領域研究「メゾスコピック神経回路から探る脳の情報処理基盤」(研究代表者:八木健)及び「神経細胞の多様性と大脳新皮質の構築」(研究代表者:平山晃斉)による助成の一環として得られました。
論文掲載情報
Toyoda S., Kawaguchi M., Kobayashi T., Tarusawa E., Toyama T., Okano M., Oda M., Nakauchi H., Yoshimura Y., Sanbo M., Hirabayashi M., Hirayama T., Hirabayashi T., Yagi T. (豊田峻輔、川口将史、小林俊寛、足澤悦子、遠山知子、岡野正樹、小田昌朗、中内啓光、吉村由美子、三宝誠、平林真澄、平山晃斉、平林敬浩、八木健)
Developmental epigenetic modification regulates stochastic expression of clustered Protocadherin genes, generating single neuron diversity. (発生期のエピジェネティック修飾はクラスター型プロトカドヘリン遺伝子群の確率的発現を制御し、個々の神経細胞を多様化する)
参考図

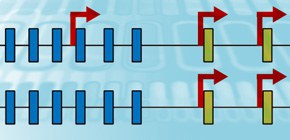
図1 クラスター型プロトカドヘリン(cPcdh)遺伝子群
α、β、γの3つの遺伝子クラスターにより、58種類の遺伝子が縦列したゲノム構造をしている(上図)。対立遺伝子ごとに独立して制御されており(下左図)、個々の神経細胞ごとに異なる遺伝子を発現することから、神経細胞の個性化に関わっていると考えられている(下右図)。
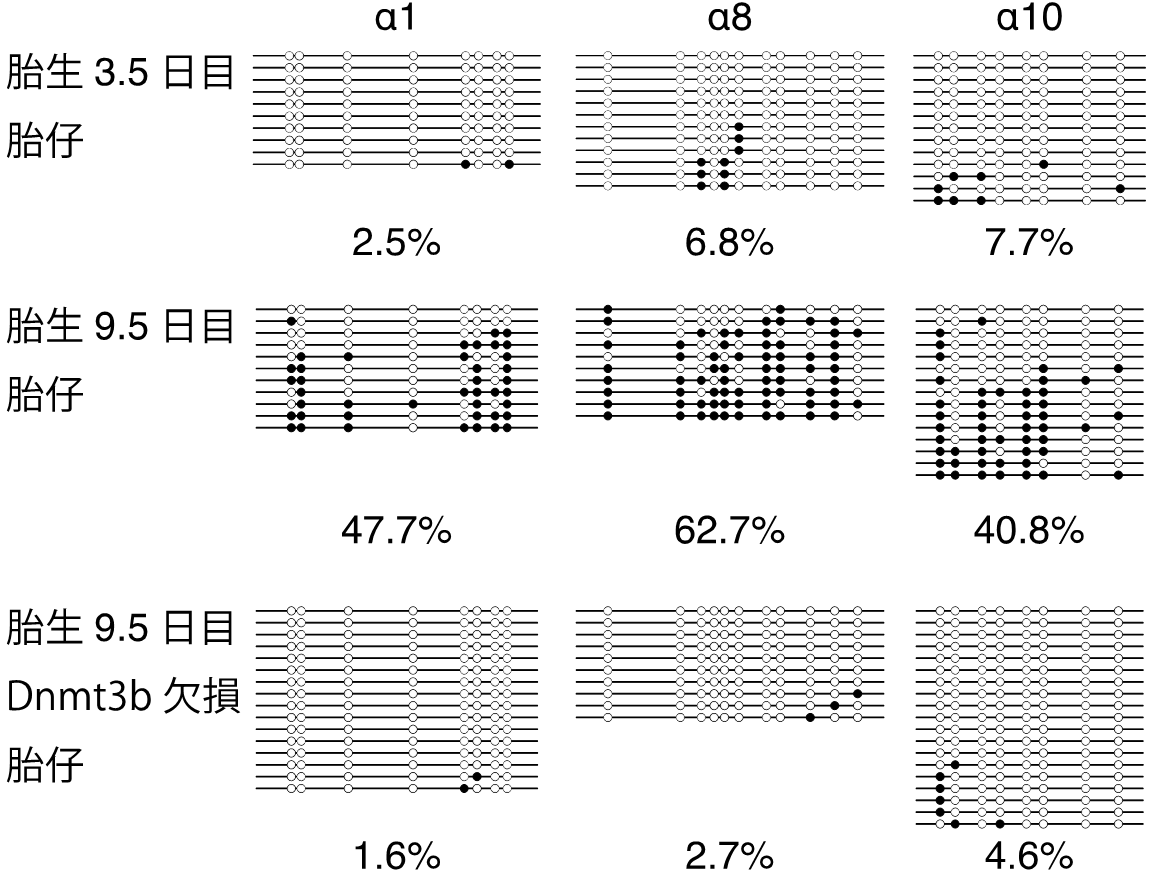
図2 cPcdh遺伝子群は発生初期にDNAメチル化される
cPcdh遺伝子のプロモーター領域は胎生3.5日目の胎仔ではほとんどDNAメチル化されていないが、発生が進んだ胎生9.5日目ではDNA鎖ごとに異なるメチル化パターンが形成されている。一方、Dnmt3b欠損マウスではほとんどメチル化されない。メチル化レベルをパーセントで表示。(横棒:DNA 一本鎖、白丸:非メチル化シトシン、黒丸:メチル化シトシン)。

図3 Dnmt3b依存的なメチル化はプルキンエ細胞の樹状突起のパターン形成を制御する
(上図)Dnmt3b欠損iPS細胞の樹立とキメラマウスの作製。(下左図)野生型およびDnmt3b欠損プルキンエ細胞の3次元構築像とトレース像。Dnmt3b欠損により樹状突起の分枝の異常が認められる(矢印)。スケールバー 50 μm。(下右図)拡大図。スケールバー 10 μm。

図4 Dnmt3b依存的なメチル化は個々の神経細胞におけるcPcdh遺伝子群のランダムな発現を制御する
(上図)キメラマウスの小脳を分散後、GFP陽性(Dnmt3b欠損;矢印)および陰性(野生型;矢頭)プルキンエ細胞のピックアップを行う。スケールバー 100 μm。(下図)単一プルキンエ細胞(Pcp2陽性)におけるPcdh-α遺伝子群の発現パターン。Dnmt3b欠損により単一細胞において発現するPcdh-α遺伝子の数が増加する。
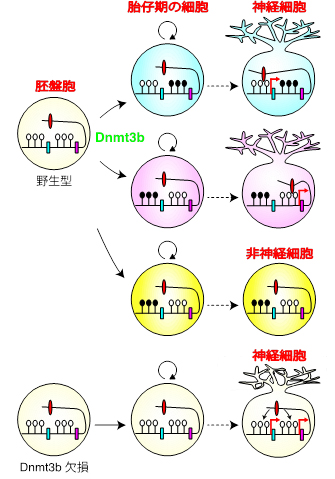
図5 まとめ
胎生3.5日目の胚である胚盤胞においてcPcdhのプロモーター領域はメチル化されていない(白丸)が、初期の胚発生期にDnmt3bによって細胞ごとに異なるメチル化パターンが形成される(黒丸)。それにより、後に産生される個々の神経細胞において、細胞ごとに異なるcPcdh遺伝子がエンハンサー(赤丸)によって選択されて発現する。一方でDnmt3b欠損細胞はメチル化されず、個々の神経細胞ですべてのcPcdh遺伝子を発現してしまうため、神経細胞の個性化が起きない。
参考URL
大阪大学大学院生命機能研究科 時空生物学講座 心生物学研究室
http://www.fbs.osaka-u.ac.jp/labs/yagi/index.htm
用語説明
- 人工多能性幹細胞(iPS細胞)
京都大学の山中伸弥教授らによって開発された万能細胞の一種。体細胞に数種類の初期化遺伝子を導入することで作製し、各種の細胞に分化することが可能。
- クラスター型プロトカドヘリン分子群(cPcdh)
細胞同士の接着に関わる遺伝子群。ヒトでは53種類の遺伝子が染色体上にクラスター状に並んでいる。同一cPcdh分子間での特異的な接着活性が認められ、神経回路形成に関与していることが明らかになっている。また、個々の神経細胞においてランダムな組み合わせで発現している。1998年に世界に先駆けて八木健教授らにより発見された。
- DNAメチル化
塩基配列の変化を伴わないDNAやヒストンの修飾メカニズム(エピジェネティック)の一つ。哺乳類では主にゲノム中のシトシン-グアニン(CG)配列内のシトシンにメチル基が付く。遺伝子プロモーター領域のメチル化は遺伝子発現の抑制に関わっている。
- プルキンエ細胞
小脳にある抑制性の神経細胞で、平面状に分枝した多数の樹状突起を伸ばし、多くの神経細胞からの入力を受ける。
