ミトコンドリア膜中での呼吸酵素の活性化の仕組みの解明
研究の概要
細胞小器官であるミトコンドリアの膜にある呼吸鎖の末端酸化酵素であるシトクロム酸化酵素は、酸素を水に変換し、生物の主要エネルギー、ATPの産生に関わっています。兵庫県立大学、大阪大学の共同研究グループ は、シトクロム酸化酵素が活性化されるしくみを分子構造に基づいて明らかにしました。この酵素の2量体構造は既に解明されていましたが、この酵素はミトコンドリア膜中では、主に単量体及び単量体が他の複合体と会合した超複合体という形態で存在します。その形態の生理的な意義はこれまで不明でしたが、今回単量体と2量体の酵素活性と原子レベルで決定された分子構造の比較から、単量体化により酸素を水へ変換するために必要なプロトン(水素イオン)の取り込みが促進される可能性が強く示唆されました。このしくみは生体内でのエネルギー生産のバランス制御において重要であると考えられます。
この研究成果は、米国科学アカデミー紀要「 Proceedings of the National Academy of Sciences of the United States of America 」に掲載されるのに先立ち、9月18日付けでオンライン公開されました。
今回の研究では、兵庫県立大学の杉村高志教授(有機化学)らが新規の界面活性剤(3OM)を合成、伊藤・新澤恭子特任准教授(生物化学)らが単量体酵素が活性型であることを示し、3OMを用いて単量体酵素を結晶化、村本和優准教授(生物物理学)及び大阪大学の青山浩准教授(構造生物学)、山下栄樹准教授(蛋白質結晶学)らが大型放射光施設SPring-8 を利用したX線結晶解析を主に担当しました。このように、物質科学・生命科学という異なる分野の研究者が、互いの結果を常にフィードバックしながら、連携し共同で進めることで研究が大きく前進しました。
研究の背景
ミトコンドリアは生体のエネルギーの産生工場です。その内膜では呼吸鎖複合体I、III、シトクロム酸化酵素へと順次電子が伝達され、シトクロム酸化酵素は我々ヒトを含む多くの生物が取り込んだ酸素(O 2 )を水(H 2 O)に変換します。これら酵素複合体が触媒する反応によってプロトン(水素イオン)が膜の内側から外側へと汲み出されます。膜を介して蓄積されたプロトンのエネルギーは、複合体Vによる生命活動に必須なアデノシン三リン酸(ATP)の合成に利用されます。
この呼吸鎖の末端酸化酵素であるシトクロム酸化酵素は、地球上で酸素を利用する生物全てにおいて生理的に非常に重要なタンパク質です。効率的にエネルギーを変換する分子であることから、その反応のしくみを明らかにするため、長年多くの研究が行われてきました。本研究グループでは、シトクロム酸化酵素をウシミトコンドリア膜から単離精製して結晶化することにより、酵素の分子構造を解明してきました。これまで詳細に解析が進められてきた全ての構造は、2個の酵素が会合した2量体と呼ばれるものでした。そのため、シトクロム酸化酵素は生理的に2量体として機能していると信じられてきました。しかし、近年になってミトコンドリア膜中での存在様式を知ることができるようになり、ほとんどのシトクロム酸化酵素は単独の状態(単量体)、又は単量体が複合体I、IIIと会合した超複合体として存在していることが明らかになりました。しかしながら、単量体と2量体とで酵素活性や分子構造を比較することが現在まで不可能だったため、シトクロム酸化酵素が異なる形態をとることの生理的な意義は明らかではありませんでした。
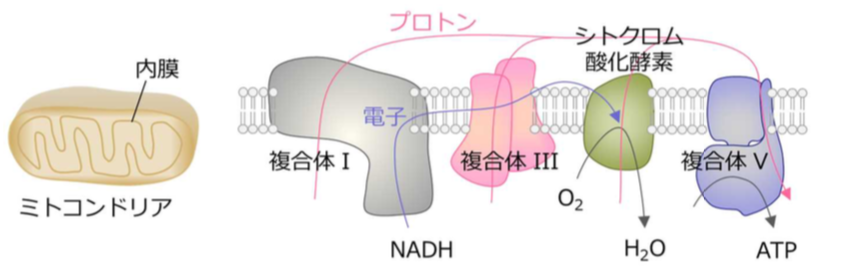
図1 ミトコンドリアの概要図
研究の手法と成果
本研究において、兵庫県立大学大学院生命理学研究科の伊藤・新澤恭子特任准教授(専門分野 生物化学)らは膜タンパク質であるシトクロム酸化酵素を単離精製するため、通常使われていた界面活性剤に代えて、Amphipolと呼ばれる両親媒性のポリマーを用いることにより酵素を単量体と2量体それぞれの状態で安定化させることに成功しました。その結果、単量体と2量体の酵素活性を厳密に比較することができるようになり、単量体の方が高い活性を示すことが明らかになりました。すなわち、単量体は酵素の「活性型」であり、2量体は活性化するための「待機型」である可能性があります。
単量体化により酵素が活性化するしくみはどうなっているのか、それを分子構造に基づいて理解するためには、単量体酵素を結晶化してその構造を決定する必要があります。しかし、本酵素の結晶化は数十年間にわたって試みられてきたものの、単量体酵素の結晶はこれまで得られていませんでした。膜タンパク質の結晶化においては使用する界面活性剤の選択が鍵となりますが、これまで知られている界面活性剤では酵素は全て2量体として結晶化されてしまいました。そこで、兵庫県立大学大学院物質理学研究科の杉村高志教授(専門分野 有機化学)らが参画し、有機合成の手法により幾種類もの界面活性剤を新規に創りだしました。それらを用いて、伊藤・新澤恭子特任准教授らが結晶化を試みた結果、3-オキサトリデシル-α- D -マンノシド(3OM)という界面活性剤を使うとこれまでとは違って単量体酵素の結晶が得られることが分かりました。
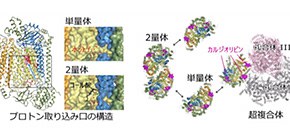
兵庫県立大学大学院生命理学研究科の村本和優准教授(専門分野 生物物理学)、大阪大学大学院薬学研究科の青山浩准教授(専門分野 構造生物学)、大阪大学蛋白質研究所の山下栄樹准教授(専門分野 蛋白質結晶学)らが大型放射光施設SPring-8を利用してX線結晶解析を行った結果、単量体構造を原子レベル(1.8Å分解能)で決定することができました。単量体と2量体での酵素活性と分子構造の比較からは、単量体化により酸素を水へ変換するために必要なプロトン(水素イオン)を取り込むための入り口の構造が変化することが明らかになりました。この構造変化によってプロトンの取り込みが促進され、単量体化による酵素の活性化が起きると考えられます。
また、2量体構造はコール酸分子が結合することによって安定化されていたことから、生体内の環境ではコール酸に類似した生理物質が結合解離することによって、酵素の状態が「待機型」と「活性型」とに変換されると推察されます。さらに、今回の構造解析からは酵素に結合しているカルジオリピンというリン脂質分子は、シトクロム酸化酵素が複合体IとIIIと会合し超複合体を形成するのに関わることも明らかになりました。超複合体の形成は酸素還元反応に必要な電子伝達の効率化や酵素自体の安定化に関わると考えられています。このように、単量体、2量体、超複合体と形態を変化させて活性を制御するしくみは、生体内でのエネルギー生産のバランス制御において重要であると考えられます。
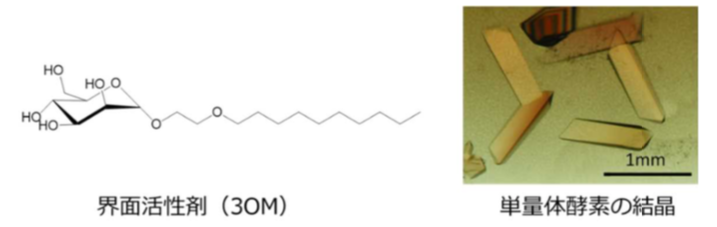
図2 界面活性剤と得られた単量体酵素
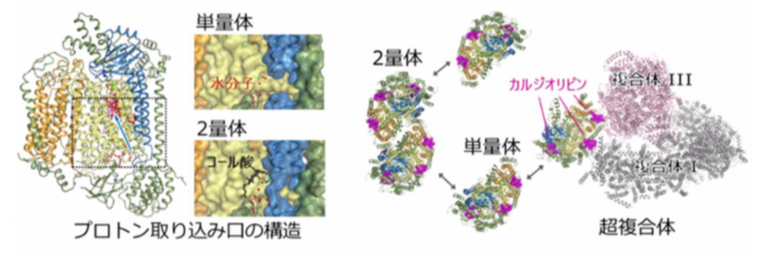
図3 プロトン取り込み口の構造と形態変化図
論文および研究支援に関する情報
論文タイトル
Monomeric Structure of an Active Form of Bovine Cytochrome c Oxidase
著者名
Kyoko Shinzawa-Itoh, Takashi Sugimura, Tomonori Misaki, Yoshiki Tadehara, Shogo Yamamoto, Makoto Hanada, Naomine Yano, Tetsuya Nakagawa, Shigefumi Uene, Takara Yamada, Hiroshi Aoyama, Eiki Yamashita, Tomitake Tsukihara, Shinya Yoshikawa and Kazumasa Muramoto
掲載学術誌
Proceedings of the National Academy of Sciences of the United States of America
DOI
10.1073/pnas.1907183116
実験支援
SPring-8大阪大学蛋白質研究所ビームライン(課題番号 2010B6500, 2011A6500)
研究費支援
日本学術振興会(JSPS)科学研究費助成事業特定領域研究(課題番号 17048028)、基盤研究B(課題番号 2370060、17H03646)、基盤研究C(課題番号 22570122、15K07029、18K06162)
研究支援者
前田友子(サンプル調製)、藤澤秀徳(データ測定)
参考URL
大阪大学 蛋白質研究所 超分子構造解析学研究室HP
http://www.protein.osaka-u.ac.jp/rcsfp/supracryst/
用語説明
- 兵庫県立大学、大阪大学の共同研究グループ
伊藤・新澤恭子 1 、杉村高志 2 、御前智則 2 、蓼原吉輝 1 、山本尚吾 1 、花田真 1 、矢野直峰 1 、中川徹也 3 、上根滋史 1 、山田聖 3 、青山浩 4 、山下栄樹 5 、月原冨武 1,5 、吉川信也 1 、村本和優 1 1兵庫県立大学大学院生命理学研究科、2兵庫県立大学大学院物質理学研究科、3兵庫県立大学理学部、4大阪大学大学院薬学研究科、5大阪大学蛋白質研究所
- SPring-8
兵庫県西部の播磨科学公園都市にある研究施設。直径約500mの円形をした装置から発生する非常に明るい光(放射光)を使って、物質の原子・分子レベルでの形や機能を調べることができる。
