世界初!ヘテロクロマチンによる染色体異常の抑制を発見
ゲノム編集を伴わない遺伝子治療につながる成果
研究成果のポイント
・染色体のヘテロクロマチン がセントロメア領域 のDNAの反復配列 を「のりしろ」にした染色体異常 を抑制することを世界で初めて発見
・ヒトと類似したクロマチン構造を持つ分裂酵母 を用いて、ヘテロクロマチンによる転写 制御が染色体異常を抑制することを明らかに
・ゲノム編集(変異)を伴わない、クロマチン制御による遺伝子治療への応用に期待
概要
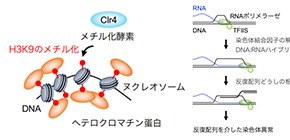
大阪大学大学院理学研究科の中川拓郎准教授、沖田暁子大学院生らの研究グループは、北海道大学の村上洋太教授、東京工業大学の木村宏教授、九州大学の高橋達郎准教授との共同研究でヘテロクロマチンがセントロメア領域のDNA反復配列(セントロメア・リピート)を「のりしろ」にした染色体異常を抑制することを世界で初めて明らかにしました (図1) 。生命の遺伝情報を担う染色体は、DNAがヒストン というタンパク質に巻き付いたヌクレオソーム (図2、灰色) を基本単位とするクロマチン構造を形成します。染色体のセントロメア領域には、DNAの反復配列(セントロメア・リピート)が存在し、凝縮したヘテロクロマチン構造が形成されます。DNA複製の進行停止などによりDNA損傷が自然発生的に起きた際、反復配列を「のりしろ」にして転座などの染色体異常が起こることがあります。こうした染色体異常がセントロメア周辺で起こるロバートソン転座 は、ヒトで最もよく見られる染色体異常ですが、どのように制御されているのか明らかとなっていませんでした。
本研究では、分裂酵母を用いて染色体の安定性におけるヘテロクロマチンの役割を調べました。その結果、ヘテロクロマチンの基盤であるヒストンH3の9番目のリシン残基(H3K9)のメチル化修飾 (図2) が、セントロメア・リピートを「のりしろ」にした染色体異常の抑制に重要であることを発見しました。通常、ヘテロクロマチンを形成するDNA領域では、DNAを鋳型にRNAを合成する転写が不活化されています。ヘテロクロマチンによる染色体異常の抑制メカニズムを明らかにするため、ヘテロクロマチンが形成できない変異株を詳細に調べたところ、転写伸長を促進する転写因子TFIIS が染色体異常を誘発することが明らかになりました (図3) 。本研究により発見した「ヘテロクロマチンの転写制御を介した染色体異常の抑制機構」は、ゲノムの半分以上を反復配列が占めるヒトなどの高等真核生物では、より重要な役割を担っていると考えられます。
本研究成果により、DNA変異を加えることなくクロマチン構造のみを操作することで、人為的に染色体の安定性を高められることが期待されます。
本研究成果は、SpringerNature社の科学誌「Communications Biology」(オンライン)に、2019年1月11日(金)19時(日本時間)に公開されました。
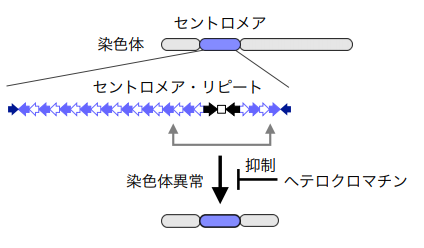
図1 ヘテロクロマチンはセントロメア・リピートを「のりしろ」にした染色体異常を抑制する
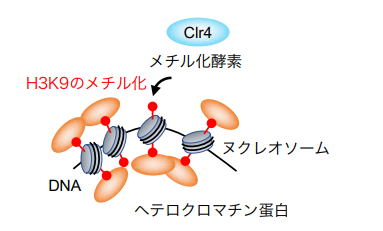
図2 Clr4がヒストンH3のK9をメチル化すると複雑なヘテロクロマチンが形成する。赤:メチル化修飾。灰色:ヌクレオソーム。オレンジ:メチル化したヒストンに結合するヘテロクロマチン蛋白。
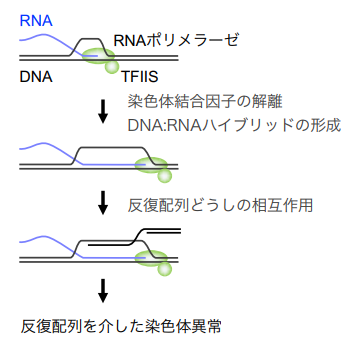
図3 TFIIS依存的な転写が染色体異常を誘発する
研究の背景と研究成果
セントロメアは、細胞分裂時に染色体の移動をつかさどる微小管(細い繊維)である紡錘糸が結合する染色体領域です。そのため、セントロメアは染色体を娘細胞に均等分配する上で極めて重要です (図1) 。しかし、セントロメアには反復配列(セントロメア・リピート)が存在するため、それを「のりしろ」にした転座などの染色体異常が生じる危険があります。染色体異常は癌をはじめ様々な遺伝病の要因となりますが、セントロメア領域での染色体異常が、どのように抑制されているのかは明らかとなっていませんでした。
セントロメアはヘテロクロマチンと呼ばれる常に凝縮したクロマチン構造を形成します。クロマチン構造が弛緩したユークロマチン領域と異なり、ヘテロクロマチン領域ではヌクレオソームを構成するヒストンH3のリシン残基(H3K9)がメチル化され、これを目印に様々なタンパク質が集合し、複雑なクロマチン構造を形成します (図2) 。その結果、ヘテロクロマチン領域では転写が起きにくいことが知られています。これまでに、マウスを用いた研究で、H3K9のメチル化酵素Clr4/Suv39を遺伝子破壊すると発癌リスクが大幅に上昇することが報告されています。また、ヒトの癌細胞でもセントロメア・リピートの転写が正常細胞に比べて上昇することが観察されています。しかし、セントロメア領域のヘテロクロマチンと染色体異常の関連は明らかとなっていませんでした。
今回、本研究グループは分裂酵母を用いて染色体の安定性におけるヘテロクロマチンの役割を解析しました。分裂酵母はヒトと類似したヘテロクロマチンを形成しますが、比較的単純な反復配列をもつため詳細な解析に適しています。H3K9のメチル化酵素Clr4/Suv39を遺伝子破壊するとセントロメア・リピートを「のりしろ」にした染色体異常が高頻度で形成されました (図4) 。
また、H3K9のリシン残基を別のアミノ酸に置換することでメチル化修飾が起きないようにした変異株でも、染色体異常が高頻度で起きました。これらの結果から、H3K9のメチル化修飾 (図2、赤) がセントロメア・リピートを「のりしろ」にした染色体異常の抑制に重要であることを明らかにしました。また、H3K9のメチル化修飾を認識するヘテロクロマチン蛋白など (図2、オレンジ) も染色体異常の抑制に必要であったことから、ヘテロクロマチンの複雑な染色体構造が重要であると考えられます。つぎに、ヘテロクロマチン欠損株で起きる染色体異常に必要な因子を探索した結果、転写伸長を促進する転写因子TFIISが染色体異常の引き金であることを明らかにしました (図3) 。TFIISは染色体に結合したタンパク質を押し退けて転写伸長するときに働きます。これらの結果から、我々は、TFIISは転写伸長を活発に起こすことで、染色体からタンパク質の解離やDNA:RNAハイブリッドの形成を促すことで、反復配列を「のりしろ」にした染色体異常を誘発するというモデル (図3) を提唱しました。
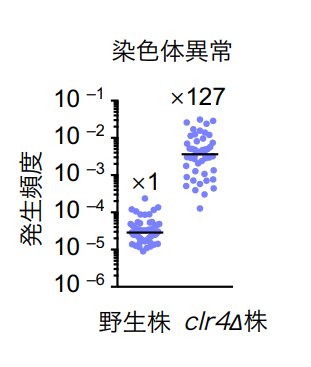
図4 メチル化酵素Clr4がないと高頻度で染色体異常が起きる
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、今後、クロマチン構造が染色体を維持するメカニズムについての研究が進むと予想されます。また、遺伝子治療への応用も期待されます。
特記事項
本研究成果は、2019年1月11日(金)19時(日本時間)に科学誌「Communications Biology」(オンライン)に掲載されました。DOI 10.1038/s42003-018-0251-z
【タイトル】“Heterochromatin suppresses gross chromosomal rearrangements at centromeres by repressing Tfs1/TFIIS-dependent transcription”
【著者名】Akiko K. Okita, Faria Zafar, Jie Su, Dayalini Weerasekara, Takuya Kajitani, Tatsuro S. Takahashi, Hiroshi Kimura, Yota Murakami, Hisao Masukata & Takuro Nakagawa.
本研究は、文部科学省科学研究費補助金 新学術領域研究「非コードDNA」、及び、日本学術振興会科学研究費補助金基盤研究Cの一環として行われました。
参考URL
大阪大学 大学院理学研究科 生物学専攻 学際グループ(分子遺伝学研究室)
http://www.bio.sci.osaka-u.ac.jp/~takuro/science/
用語説明
- ヘテロクロマチン
細胞の核内では、DNAはヌクレオソームを基本単位として複雑な高次構造を形成します。これをクロマチンと呼びます。クロマチンは、常に凝縮した状態のヘテロクロマチンと弛緩したユークロマチンに分かれます。こうしたクロマチン構造は、DNA配列により一義的に決定されておらず、ヌクレオソームを構成するヒストンの修飾により可逆的に変化します。ただ、興味深いことに、反復配列が存在する染色体領域は概ねヘテロクロマチン構造を形成します。
- セントロメア領域
全ての染色体に1箇所ずつ存在する染色体領域であり、染色体の移動をつかさどる微小管(細い繊維)である紡錘糸が結合する動原体が形成されます。そのため、セントロメアは正確な染色体分配に不可欠です。多くの真核生物のセントロメア領域は生物種に特徴的なリピート配列によって構成されています。
- DNAの反復配列
セントロメアやテロメアに存在する反復配列や(レトロ)トランスポゾン由来の反復配列など様々な種類の反復配列があります。ゲノム上に存在する反復配列を「のりしろ」にして染色体異常が生じることがあります。これにより、癌などの遺伝病が誘発されます。一方、進化の過程で、生物が遺伝的多様性を獲得する際にも、反復配列は重要な役割を果たしてきたと考えられています。
- 染色体異常
転座、逆位、欠失など染色体の大きな変化。染色体異常により大切な遺伝子が破壊されたり、遺伝子数が変化したりすることで、癌をはじめダウン症、ターナー症などの様々な遺伝病が引き起こされます。
- 分裂酵母
学名 Schizosaccharomyces pombe。アフリカでビールの生産に使用されていた酵母です。出芽ではなく隔壁ができることで細胞分裂します。ヒトと共通したクロマチン構造を持ちますが、染色体数が3本と少なく、解析しやすいため染色体の研究に使用されることの多いモデル生物です。
- 転写
染色体のDNA鎖を鋳型にしてRNA鎖を合成する反応。RNAポリメラーゼにより合成されたRNAが鋳型DNAと対合したままDNA:RNAハイブリッドを形成することがあります。DNA:RNAハイブリッドが形成されると元の2本鎖DNAの片側が1本鎖となります。この1本鎖DNAが反復配列どうしの認識に使われることで染色体異常が生じる可能性があります。
- ヒストン
進化上高度に保存されたDNA結合タンパク質。H2A,H2B,H3,H4の4種類のヒストンが2分子ずつ集合して8量体を形成し、その周囲にDNAが巻き付いて、ヌクレオソームを形成します。ヒストンの末端領域がヌクレオソームの表面に位置しており、メチル化などの修飾を受けます。修飾の種類や位置の違いによりクロマチンの構造が変化します。
- ヌクレオソーム
ヒストンから構成されるタンパク質複合体にDNA鎖が巻き付いたタンパク質とDNAの複合体。クロマチン構造の基本単位。
- ロバートソン転座
転座の中でも、2本の染色体が短腕を失い、セントロメア周辺で連結して、1本の染色体となるものをロバートソン転座といいます。ロバートソン転座は1916年にウイリアム・ロバートソンが昆虫のバッタで初めて報告した様式の染色体異常です。流産や不妊などとの関連が指摘されています。
- 転写因子TFIIS
転写においてRNAポリメラーゼの働きを助けるタンパク質を転写因子と言います。様々なタンパク質が結合する染色体上では転写はたびたび途中停止します。そうしたとき、転写因子TFIISはRNAポリメラーゼの触媒部位に作用することでRNAポリメラーゼの進行再開を助け、転写の伸長過程を促進します。
