特殊な細胞膜の脂質が免疫を暴走させる!
短い脂肪酸をもつスフィンゴミエリン(SM C12)が自然免疫を強く刺激し 炎症を起こす細胞死を誘導する仕組みを解明
研究成果のポイント
概要
大阪大学放射線科学基盤機構の黄栩昊(コウ シュウホ)特任助教(常勤)(研究当時 大学院理学研究科博士後期課程)、大阪大学放射線科学基盤機構の樺山一哉教授、深瀬浩一特任教授(常勤)らの研究グループは、慶應義塾大学の狩野裕考特任助教、鳥取大学の花島慎弥教授、東北医科薬科大学の稲森啓一郎教授らとの共同で、スフィンゴミエリン(SM)の脂肪酸鎖長の違いが自然免疫のスイッチをオン・オフする鍵となることを世界で初めて明らかにしました。
特に短鎖型「SM C12」は、マクロファージに強い炎症性サイトカイン(IL-1α、IL-6 など)を誘導し、細胞膜上に水を取り込む穴を形成するタンパク質であるガスダーミンDに依存的なパイロトーシス(細胞の膨化と破裂を伴う炎症性細胞死)を引き起こすことがわかりました。さらに、SM C12はヒトのカスパーゼ-4(マウスではカスパーゼ-11)に直接結合し、細胞内の炎症センサーを作動させる新規リガンドであることも実証しました。
これらの成果は、自然免疫の理解を大きく前進させるだけでなく、過剰炎症を制御する治療の開発につながる可能性があります。
本研究成果は、米国科学誌Cell Reportsに2025年11月19日(日本時間)にオンライン掲載されました。
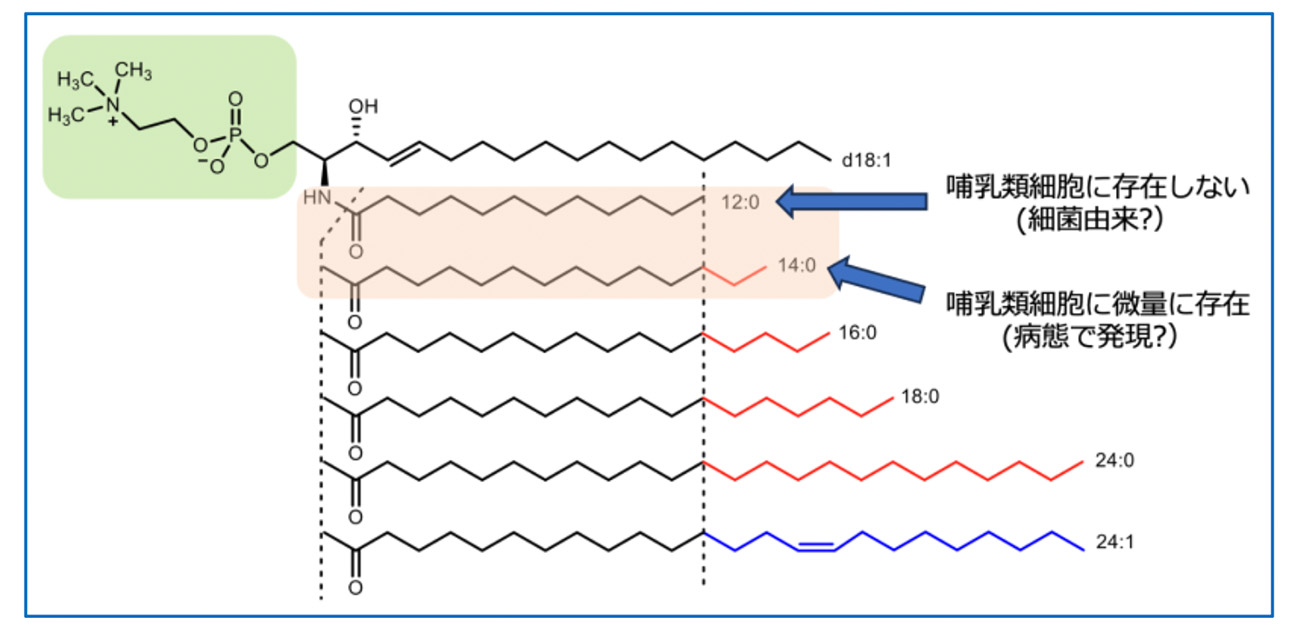
図1. 脂肪酸鎖長の異なるスフィンゴミエリン(SM)の構造。炭素鎖が12個(C12)、14個(C14)のSM以外は哺乳類細胞に多く存在する。
研究の背景
私たちの体には、細菌やウイルスといった外敵をいち早く察知し、防御反応を開始する自然免疫という仕組みがあります。その中心的な役割を担う受容体の一つが TLR4(Toll-like receptor 4)です。TLR4は細菌由来のLPSといった異物を見つけると炎症反応を引き起こし、体を守る働きをします。しかし、TLR4が必要以上に活性化すると、炎症が暴走し敗血症のような重篤な症状を招くことがあります。また、慢性炎症や自己免疫疾患の悪化にも関わることが知られています。したがって、TLR4の働きを適切に制御する仕組みを理解することは、医学において非常に重要な課題です。
一方、私たちの細胞膜にはスフィンゴ脂質と呼ばれる脂質が豊富に存在しています。これまでは細胞膜の構造を担う“材料”というイメージが中心でしたが、近年になって、脂質のわずかな構造の違いが免疫や炎症の制御に深く関わる ことが明らかになりつつあります。その中でもスフィンゴミエリン(SM)は、脂肪酸の「鎖長」の違いによって多様な分子種が存在し(図1)、それぞれが体内でどのような働きを持つのかは、長らく未解明のままでした。
さらに、炎症性細胞死(パイロトーシス)を引き起こす細胞内センサーであるカスパーゼ-4/11が、体内の脂質によってどのように調節されるのかについても、多くの謎が残されていました。こうした背景のもとで、「脂質の鎖長という、わずかな化学構造の差異が、自然免疫のスイッチをどのように切り替えるのか」という問いは、免疫学と脂質生物学の両分野において大きな関心を集めていました。
本研究グループは、この重要な問いに正面から取り組み、脂質鎖長の違いが自然免疫の働きをどのように制御するのかを明らかにすることを目指して研究を進めました。
研究の内容
研究グループは、まずスフィンゴミエリン(SM)の「脂肪酸鎖の長さ」が違ういくつかのタイプ(C12、C14、C16、C24 など)を用いて、マクロファージという免疫細胞がどのように反応するのかを詳しく調べました。すると、脂肪酸が短い SM C12だけが、強い炎症反応を引き起こし、IL-1α、IL-6、TNFαといった炎症性サイトカインを大量に作り出すことがわかりました。
さらに、SM C12を与えた細胞では、細胞がふくらんで破裂する、といったパイロトーシス特有の形態変化が見られました。これは、短鎖のスフィンゴミエリンが非常に強い炎症性の細胞死を誘導することを示しています。
次に研究グループは、SM C12がどの受容体を通じて細胞に働きかけているのかを調べました。その結果、TLR4とMD2という分子が組み合わさった TLR4/MD2複合体がこの反応に必須であることが判明しました。実際に、TLR4の働きを抑える薬(TAK-242)を使うと、SM C12によるサイトカイン放出や細胞死が大幅に減少しました。さらに、TLR4/MD2を発現している細胞を使った実験でも、SM C12がTLR4を介してNF-κBを活性化することが確認されました。
一方で、興味深い発見もありました。脂肪酸鎖が長いSM(C16〜C24)は、逆にLPSによる炎症反応を抑える働きを持つことが分かったのです。つまり、SM の鎖長の違いが、炎症を「強める」か「抑える」かを決定していたことになります。また、C14型のSMは濃度を高くした場合にのみ炎症反応を起こすことがわかり、C12とC14という、わずか2炭素の違いが炎症活性を大きく左右することも明らかになりました。
さらに研究グループは、SM C12が細胞の中にも入り込み、カスパーゼ-4/11という分子に直接結合する新しいタイプのリガンドであることを明らかにしました。カスパーゼ-4/11は、通常は細胞内に侵入したLPSなどの異物を見つけたときに 自分自身が集まって塊(オリゴマー)を作り、その後ガスダーミンDというタンパク質に働きかけて、細胞膜に水が流れ込む穴をあけ、細胞を破裂させる役割を持っています。研究の結果、SM C12もLPSと同じように、このオリゴマー化を引き起こすことが確認されました。
また、コンピューターを使った分子ドッキング解析(分子同士がどのように結合するかを予測する手法)により、SM C12はTLR4/MD2の活性型ポケットと呼ばれる部分に深く入り込み、LPSの活性本体であるLipid Aに似た結合の仕方をすることが示されました。これは、なぜSM C12が強力にTLR4を活性化できるのかという構造的な理由を説明する重要な結果です。一方、脂肪酸鎖が長いSM(C16〜C24)がTLR4に結合しづらい理由も、結合のパターンがSM C12とは大きく異なるためであることが明らかになりました。
以上の研究結果から、SM C12は「細胞の外側で働くTLR4」と「細胞の内側で働くカスパーゼ-4/11」という、2つの異なる分子を時間差で活性化できる特別な脂質であることが明らかになりました(図2)。このことは、スフィンゴミエリンの脂肪酸鎖の長さが、自然免疫の働きを細かく調整するうえで非常に重要であることを示しています。さらに、SM C12 はこれまで 体内でほとんど確認されていない珍しい分子で、その性質はむしろ 細菌がもつ脂質に近いことがわかっています。そのため、自然免疫にとって 「外から来た危険信号」=PAMPs(病原体関連分子パターン)として働く可能性が高いと考えられます。一方、脂肪酸鎖が少し長い SM C14は、哺乳類の細胞内に ごくわずかに存在することが知られています。このSM C14は、細胞が傷ついたときに外に漏れ出すことで免疫を刺激する、「細胞のダメージを知らせる信号」=DAMPs(損傷関連分子パターン)として働く可能性が示されています。今後、研究グループは細菌が作る脂質や、病気のときに血液中に現れる脂質を用いて、自然免疫と脂質の関係をさらに深く理解する研究を進めていく予定です。
図2. SM C12はTLR4シグナル経路を活性化した後、パイロトーシスによる細胞死を引き起こす
本研究成果が社会に与える影響(本研究成果の意義)
本研究は、脂質の「鎖の長さ」という、わずかな構造の違いが免疫の働きを大きく左右する鍵であることを示しました。この発見により、感染症や自己免疫疾患で起こる過剰な炎症を抑える新しい方法の開発につながると期待されます。さらに、免疫の力を適切に高める ワクチンの補助剤(アジュバント) の設計や、がんと戦うための新しい免疫治療の戦略にも応用できる可能性があります。つまり、本研究は「脂質が免疫をどう動かすのか」という重要な仕組みを明らかにしたことで、未来の医療の発展に大きく貢献しうる成果だといえます。
特記事項
本研究成果は、2025年11月19日(日本時間)に米国科学誌「Cell Reports」(オンライン)に掲載されました。
【タイトル】“Modulation function of sphingomyelin molecular species in TLR4 signaling and cell death”
【著者名】黄栩昊1,2, 狩野裕考4,5, 上野純平1, 石川潮4,5, 新田昂大5, 髙松正之1,2, 下山敦史1,2,3, 谷口真6, 花島慎弥7, 稲森啓一郎5 井ノ口仁一3,5, 深瀬浩一1,2,3, 樺山一哉1,2,3,*(*責任著者)
【所属】
1. 大阪大学 大学院理学研究科 化学専攻
2. 大阪大学 放射線科学基盤機構 附属学際研究センター
3. 大阪大学 大学院理学研究科 附属フォアフロント研究センター
4. 慶應義塾大学 先端生命科学研究所
5. 東北医科薬科大学 分子生体膜研究所
6. 金沢医科大学 総合医学研究所
7. 鳥取大学 大学院工学研究科
URL: https://www.cell.com/cell-reports/fulltext/S2211-1247(25)01340-3
DOI: https://doi.org/10.1016/j.celrep.2025.116568
本研究は、日本学術振興会 科学研究費補助金(基盤研究(B)21H02080、基盤研究(C)24K09783・21K06530、特別研究員奨励費 22J10766、挑戦的研究(萌芽)23KK0285、特別推進研究 JP25H00006、基盤研究(S)JP20H05675)ならびに JP25K01914 の支援を受けて実施されました。また、AMED(日本医療研究開発機構)JP223fa727001s0301、JST FORESTプログラム(JPMJFR230C)、ワクチン研究開発拠点(Japan Initiative for World-leading Vaccine Research and Development Centers)、先端モダリティ・DDS(CAMaD)の支援を受けました。加えて、上原記念生命科学財団、小野医学研究財団、持田記念医学薬学振興財団、武田科学振興財団からの支援も受けました。

