生きた細胞の中で狙った分子を光で標識する
特定分子を選択的に観察、創薬分野への応用に期待
研究成果のポイント
- 細胞内分子の挙動に影響を与えない、小さな光応答性の分子標識を開発
- 従来技術では、細胞内への応用に課題があったが、新たに末端アルキンを光応答性にすることで細胞内でも狙った分子の検出が可能に
- 細胞間の液性コミュニケーションを明らかにするなど、生物学的な細胞機能の解明や創薬への応用に期待
概要
大阪大学産業科学研究所の山口哲志教授、梅田侑生特任研究員(常勤)、朱浩助教、東京大学大学院工学系研究科の岡本晃充教授らの研究グループは、光照射によりアルキンへと変換される新しい化学構造を開発し、この構造を観察対象となる分子に修飾することで、光に応答した分子を細胞内で可視化することに成功しました。
これまでにも、分子への影響が極めて小さい低分子量のアルキンタグを光応答性にする技術は開発されてきましたが、光で変換されたアルキンが細胞内の分子と反応して別の構造になってしまい、標識として用いることができませんでした。
今回、研究グループは、光照射によって細胞内で安定な末端アルキン構造に変換できる化学構造を新たに開発しました。この構造をコレステロールに修飾し、細胞内に取り込ませたところ、光照射依存的にその細胞内での局在を可視化することに成功しました。この技術は、光を照射した場所に存在した分子だけを選択的に可視化することができ、細胞内オルガネラ間や細胞間での分子の受け渡しといった、これまで可視化できなかった分子動態の解明やそれをターゲットとした創薬への応用が期待されます。
本研究成果は、独国科学誌 『ChemBioChem』 (オンライン)に5月14日に先行掲載された後、9月17日に刊行された同誌のカバーアートに選出されました。
概要図
生きた細胞の中での光応答的な分子標識技術。光照射によってアルキンの保護基が外れ、検出が可能になる。
研究の背景
これまで、生体内分子の機能を明らかにするために用いられてきた様々な標識手法のタグの中でも、アルキンは特に小さい構造をもち、標的生体分子の挙動に与える影響が少ないことが知られています。そして、標識した分子の動態をより詳細に解析するため、特定の時空間内の分子のみを光刺激によって選択的に標識するという手法が広く使用されてきました。しかし、これまでに開発された光応答性のアルキンタグはジベンゾシクロオクチン(DBCO)構造をもつため、細胞内のチオール基とランダムに反応してしまい、細胞内で分子標識に用いるのは困難でした。そのため、細胞内でも使用可能な光応答性のアルキンタグの開発が求められてきました。
研究の内容
研究グループではEschenmoser–Tanabe開裂反応の反応中間体に光分解性保護基を修飾することで、光照射によって細胞内でも利用可能なアルキンタグへと変換するタグ標識技術を開発しました(図1)。これによって生じるアルキンは末端アルキンであるため、細胞内のチオール基とは反応せず、標識のために後から導入するアジド基とのみ選択的に反応させることができます。
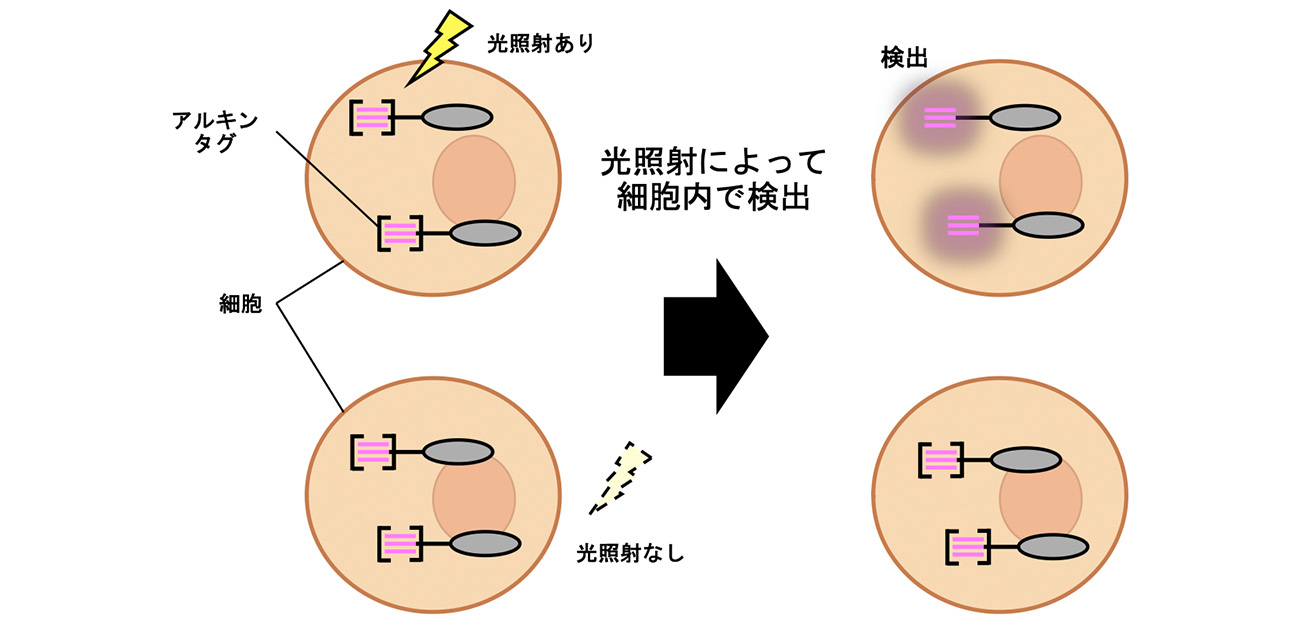
さらに、コレステロール分子にこの光機能化型タグを標識して実際に細胞内に導入することで、光照射依存的にコレステロール分子の細胞内分布を可視化することに成功し、細胞内での使用が可能であることが示されました(図2)。
図1. 新規開発したアルキンタグの分子構造。Eschenmoser-Tanabe 開裂反応の反応中間体に光分解性保護基を反応させることで合成した。光照射の後、加水分解を受けてアルキンが生成される。
図2. 細胞内で可視化したアルキンタグの画像。光照射した細胞でのみ明るい蛍光として観察されており、光照射をしていない細胞からはほとんど蛍光が観察されない。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、特定の細胞、あるいは細胞内の一部にある目的分子のみを光で脱保護し、その本来の動態に限りなく近い挙動を追跡することが可能となります。これにより、ある細胞内のオルガネラ間や、異なる細胞間での液性コミュニケーションを明らかにし、創薬や疾患の治療に役立てられることが期待されます(図3)。
図3. 本研究成果の将来の展望。特定の細胞から他の細胞への液性因子の伝達経路をより詳細に調べることができるようになると期待される。
特記事項
本研究成果は、2025年5月14日に独国科学誌 『ChemBioChem』 (オンライン)に先行掲載された後、同誌の名誉あるカバーアートに選ばれ、9月17日に出版されました。
タイトル:“Photoactivatable Alkyne Tag for Photolabeling Biomolecules in Living Cells”
著者名:Yuki Umeda, Hao Zhu, Satoshi Yamaguchi, Sho Nakamura, Masato Takada, Shin Izuta and Akimitsu Okamoto
DOI:https://doi.org/10.1002/cbic.202500190
なお、本研究は、JST 戦略的創造研究推進事業(CREST)(JPMJCR2434)研究の一環として行われ、東京大学大学院工学系研究科 岡本晃充教授のご指導の下で行われました。
図4. 『ChemBioChem』 の表紙に掲載されたイメージアート。王冠がアルキンを模しており、細胞に光を当てることでアルキンが付与されることを表している。
参考URL
大阪大学産業科学研究所 山口研究室
https://www.sanken.osaka-u.ac.jp/labs/moc/
SDGsの目標
用語説明
- 分子標識
対象に対して、目印となる分子を標識すること。
- 末端アルキン
アルキンは炭素原子間の三重結合からなる構造で、窒素3原子からなるアジド基と選択的に反応し共有結合を形成する。そのようなアルキンの中で、両端のうちの一方に結合しているのが水素原子であり、全体的な化合物の構造の末端に位置しているものを末端アルキンと呼ぶ。
- 液性コミュニケーション
生体内において、細胞間でホルモンや神経伝達物質などの小分子を介して情報伝達を行うこと。
- オルガネラ
核やミトコンドリアなど、真核細胞の中において特定の機能を担う区画化された構造体。
- タグ
特定の分子(タンパク質やDNAなど)に付加することで当該の分子の検出や精製のために用いられる、ペプチド配列やその他の小分子。
- ジベンゾシクロオクチン(DBCO)
立体的に歪ませることで反応性を高めたアルキンの一種。反応性が高いため、アジド基以外の分子構造とも反応してしまう。
- チオール基
ヒドロキシ基の酸素原子を硫黄原子に置換したS-H構造をとる官能基。
- Eschenmoser–Tanabe開裂反応
環構造が開裂することでアルキンを生じさせる反応。
- 光分解性保護基
元の構造が他分子と反応するのを防ぐ役割を担う保護基のうち、光が当たると分解されて脱保護されるもの。
- アジド基
窒素3原子からなるN₃構造をとる官能基。

