新技術「時間決定型クライオ光学顕微鏡法」を開発
細胞を瞬時に“止めて”、じっくり観察!
動画: 細胞内を伝わるカルシウムイオン波の急速凍結。ラット培養心筋細胞に蛍光カルシウムイオン指示薬を導入し観察。(※画像クリックで再生されます)
研究成果のポイント
- 光学顕微鏡観察中の細胞を、任意のタイミングかつ、ミリ秒(1000分の1秒)レベルの時間精度で凍結固定し、その瞬間の細胞状態を観察できる新たなクライオ光学顕微鏡技術を開発。
- これまでの細胞動態観察では、素早い細胞の動きを正確に捉えるために露光時間を短くすると、得られる光信号量が減少し、物質量の変化の正確な測定や細部までの詳細な観察が難しくなることが課題でした。
- カルシウムイオンの伝搬やオルガネラ(細胞内小器官)の動きなどの細胞動態を観察しながら瞬時に“止め”、十分に時間をかけて定量性の高い観察や、超解像顕微鏡による3次元観察などが可能に。
- 時間の経過とともにダイナミックに分布や状態が変化する細胞の生命現象や細胞応答などを、高い定量性かつ高空間分解能で可視化する手段として、生命科学・医学分野への幅広い研究に応用が期待。
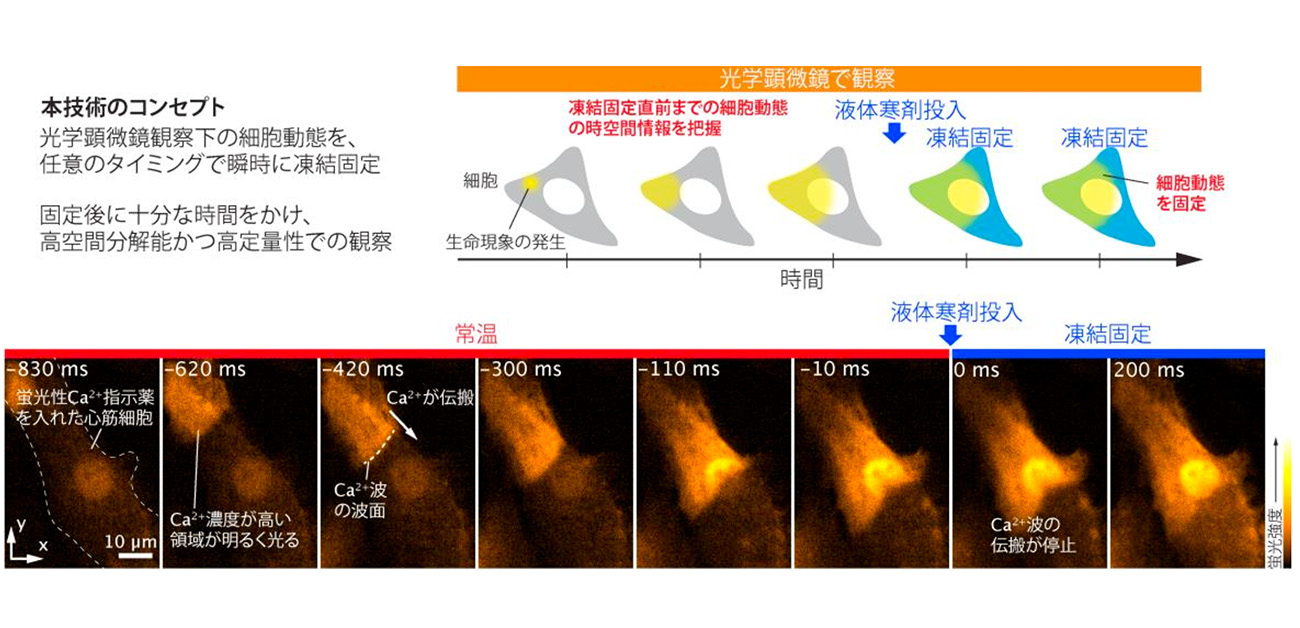
図1. (上)本研究成果の技術のコンセプト。(下)蛍光顕微鏡で観察中のラット初代培養心筋細胞内を伝搬するCa²⁺波を急速凍結固定。細胞にはCa²⁺濃度が高くなると明るく光る蛍光性Ca²⁺指示薬を導入。細胞の左上から右下に流れるCa²⁺波が急速凍結により瞬時に停止し、凍結直前の細胞内Ca²⁺分布が保持されている様子が確認できる。
概要
大阪大学大学院工学研究科の大学院生の辻康介さん(博士後期課程)、山中真仁特任准教授(常勤)、藤田克昌教授、同 先導的学際研究機構の熊本康昭准教授らの研究グループは、同 免疫学フロンティア研究センターのNicholas I. Smith准教授、同 産業科学研究所の永井健治教授、京都府立医科大学の原田義規教授、田中秀央特任教授、Howard Hughes Medical InstituteのMeng C. Wang博士、Zhiheng Yu博士、Friedrich-Schiller-University JenaのRainer Heintzmann教授らと共同で、光学顕微鏡で観察中の細胞を、任意のタイミングかつミリ秒(図中ではmsと記載)レベルの時間精度で凍結固定し、そのまま詳細に観察できる技術「時間決定型クライオ光学顕微鏡法(Time-deterministic cryo-optical microscopy)」の開発に成功しました(図1)。本技術は、凍結固定の直前まで細胞内で「どのような現象がどの場所で起きていたか」という細胞動態に関する時空間情報を把握しつつ、細胞動態の「ある瞬間」の状態を高い定量性かつ空間分解能で可視化するもので、光学顕微鏡による生体試料観察を基盤とする生命科学・医学分野の研究への幅広い応用、貢献が期待されます。
本研究成果は、国際学術誌「Light: Science & Applications」に、8月23日(土)午後(日本時間)に公開されました。
研究の背景
細胞内で生じる生命現象は、形態変化や分子状態、イオン濃度分布の変動などを伴い、短時間のうちに様相を大きく変化させます。このような現象を正確に捉え、理解するためには、高い時間分解能での観察が求められます。細胞動態の観察には、従来、蛍光顕微鏡などの光学顕微鏡が広く用いられてきましたが、時間分解能を高くするために露光時間を短くすると得られる光信号量が低下し、それによって定量性や空間分解能が低下するというトレードオフが存在していました。細胞の動きを固定する方法としては化学固定が広く利用されていますが、固定に数分以上の時間を要するため特定の瞬間での固定は難しく、形態は固定できるものの、イオン濃度分布や細胞の化学状態などを変化させてしまうという課題がありました。また、光学顕微鏡には、超解像顕微鏡、蛍光寿命イメージング技術、3次元イメージング技術などといった細胞の形態や機能などを可視化する様々な技術がありますが、これらの多くは数100ミリ秒から数分程度という比較的長い画像取得時間を要し、観察できる細胞動態は限られていました。
研究の内容
研究グループでは、光学顕微鏡で細胞を観察中に急速凍結固定し、その凍結状態のまま試料を詳細に観察できるという簡便に扱える試料凍結チャンバー(チャンバー:顕微鏡観察時に細胞試料を入れる容器)を開発しました(図2(左))。開発したチャンバーでは、十分な凍結速度を確保するため細胞周囲の緩衝液量を減らした後に、液体イソペンタン−プロパン混合寒剤(−185度程度)を注入し、試料を急速に凍結固定します。注入された混合寒剤はそのまま試料上に留まり、急速凍結後も低温が維持されます。様々な市販の光学顕微鏡に容易に取り付け可能で、スペアのチャンバーパーツを用いれば、試料交換も1分程度で行えます。さらに、本研究では、電動制御により±10ミリ秒の精度で混合寒剤を試料に注入する寒剤滴下装置も併せて開発しました。
本研究では、開発した試料チャンバーを用い、細胞内を高速に伝搬するカルシウムイオン(Ca²⁺)(図1)や、細胞内でダイナミックに動く細胞内小器官などを瞬時に凍結固定することに成功しました。Ca²⁺分布の凍結後には、長時間露光により信号対ノイズ比を大幅に向上させることにも成功し、凍結後に高い定量性で細胞を観察できることを実証しました(図2️(右))。また、細胞内Ca²⁺分布とアクチンフィラメントの2色超解像や細胞内Ca²⁺分布の3次元超解像観察にも成功し、比較的長い露光時間を要する観察技術においても、細胞の“ある瞬間”を可視化ができることを示しました(図3)。さらに、細胞の光刺激技術と電動制御の寒剤滴下装置を利用し、細胞内現象の発生から凍結固定までの時間を任意かつ±10ミリ秒の精度で決定できることを示しました(図4)。これらに加え、凍結後の試料を超解像蛍光顕微鏡とラマン顕微鏡で観察し、観察に必要な時間が異なる複数の光学イメージング技術であっても(超解像蛍光顕微鏡の撮像時間:750ミリ秒、ラマン顕微鏡の撮像時間:25分)、同一時点の細胞状態を可視化、解析できることを実証しました。これらの成果に基づき、研究グループはこの技術を「時間決定型クライオ光学顕微鏡法」と名付けました。
図2. (左)クライオ光学顕微鏡の試料チャンバーの断面図と実際の写真。低温下で破損せず、低温を維持しやすい材料を選定し、3Dプリンターで作製。緩衝液をピペットで減らした後に、上部からイソペンタン-プロパン混合寒剤を注入し急速凍結。(右)Ca²⁺が細胞内を伝搬している細胞を凍結固定後に(図1)、露光時間を長くすることで蛍光観察像の信号対ノイズ比を大幅に向上(露光時間を1000倍にし、信号対ノイズ比を8.9から340まで向上)
図3. (左)拍動しているラット初代培養心筋細胞を顕微鏡観察下で凍結し、その後、超解像観察。広視野顕微鏡による観察像(従来と記載のもの)と比較し、超解像顕微鏡により細胞内のCa²⁺分布とアクチンフィラメントの構造がより詳細に観察できていることがわかる。(右)Ca²⁺が細胞内を伝搬しているラット初代培養心筋細胞を凍結固定し、3次元超解像観察。これらの超解像観察には構造化照明顕微鏡を利用。
図4. 細胞内のCa²⁺伝搬の発生から凍結固定までの時間を±10ミリ秒の時間精度で決定。(左)ラット初代培養心筋細胞に紫外波長のレーザー光を照射することで(光刺激)、細胞内でCa²⁺の伝搬を誘起。Ca²⁺は伝搬し続ける。(右)光刺激し、その120ミリ秒後に急速凍結固定。光刺激のための紫外波長レーザー照射と寒剤滴下装置による寒剤滴下のタイミングは共に、電気信号で高精度に制御。
本研究成果が社会に与える影響(本研究成果の意義)
本研究で開発した「時間決定型クライオ光学顕微鏡法」は、光学顕微鏡観察下の細胞内現象を任意のタイミングで凍結固定し、固定直前までの細胞内現象の時空間情報を踏まえたうえで、その瞬間の状態を高精度に可視化できる技術であり、クライオ光学顕微鏡を基軸とした新たな研究領域の開拓に資する技術になると期待されます。バイオイメージングを基盤としている生命科学・医学分野への幅広い応用が見込まれるとともに、今後、電子顕微鏡などの他の計測技術を組み合わせることで、細胞の状態、機能、薬剤応答を制御する分子構造を明らかにするなど、分子レベルでの生命機能解明にも大きく貢献すると期待されます。
特記事項
本研究成果は、2025年8月23日(土)午後(日本時間)に国際学術誌「Light: Science & Applications」(オンライン)に掲載されました。
タイトル:“Time-deterministic cryo-optical microscopy”
著者名: Kosuke Tsuji*, Masahito Yamanaka*, Yasuaki Kumamoto, Shoko Tamura, Wakana Miyamura, Toshiki Kubo, Kenta Mizushima, Kakeru Kono, Hanae Hirano, Momoko Shiozaki, Xiaowei Zhao, Heqi Xi, Kazunori Sugiura, Shun-ichi Fukushima, Takumi Kunimoto, Yoshino Tanabe, Kentaro Nishida, Kentaro Mochizuki, Yoshinori Harada, Nicholas I. Smith, Rainer Heintzmann, Zhiheng Yu, Meng C. Wang, Takeharu Nagai, Hideo Tanaka, Katsumasa Fujita
*共同筆頭著者(Kosuke Tsuji and Masahito Yamanaka contributed equally)
DOI:https://doi.org/10.1038/s41377-025-01941-8
なお、本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST(多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出)研究課題名「多細胞の包括的分子イメージング技術基盤の構築」研究(JPMJCR1925)、同 共創の場形成支援プログラム(COI-NEXT)「フォトニクス生命工学研究開発拠点」研究(JPMJPF2009)、同 次世代研究者挑戦的研究プログラム(SPRING)「学際融合を推進し社会実装を担う次世代挑戦的研究者育成プロジェクト」(JPMJSP2138)の一環として行われました。また、本研究の一部は、ドイツ研究振興協会(DFG)(SFB1278(TP C04))、ライプニッツ協会(Leibniz Science Campus「InfectoOptics」、および「HotAim 2.0」)、Janelia Research Campus, Howard Hughes Medical Instituteの支援を受けて行われました。
参考URL
藤田克昌教授 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/c741122dc333cd8c.html
大阪大学 大学院工学研究科 物理学系専攻 応用物理学コース
https://lasie.ap.eng.osaka-u.ac.jp/home_j.html
大阪大学 先導的学際研究機構
https://otri.osaka-u.ac.jp
SDGsの目標
用語説明
- 凍結固定
細胞などの生体試料を急速に冷却し凍結することで、内部構造、分子状態、イオン濃度分布などを自然に近い状態に保ったまま固定する手法。試料中の水をガラス化させることで氷晶の形成を防ぎ、生体構造の損傷を抑えた状態で固定できる。電子顕微鏡観察用の試料作製に広く利用されている。
- クライオ光学顕微鏡
凍結した試料を低温、凍結状態のまま観察できる光学顕微鏡。従来のクライオ光学顕微鏡では、試料は顕微鏡外で凍結固定されるため、凍結固定した試料の温度を低温に保ったまま顕微鏡に移送するための専用の低温輸送システムも必要とされる。
- カルシウムイオンの伝搬
カルシウムイオンは細胞内で様々な信号を伝達する物質であり、細胞への刺激や、細胞活動に応じて細胞内の濃度が変化し、細胞内を伝わって行く様子が見られる。
- 定量性
試料中の物質などの量を測定できるという性質。
- 超解像顕微鏡
従来の光学顕微鏡の限界(回折限界)を超えた空間分解能で試料を観察できる顕微鏡。蛍光顕微鏡で多くの手法が報告されており、代表的な手法に、誘導放出制御(STED)顕微鏡、単一分子局在化(single molecule localization)顕微鏡、構造化照明(SIM)顕微鏡などがある。
- 蛍光顕微鏡
試料に光(励起光)を照射し、試料から発せられる蛍光を検出し、マッピングすることで試料中の蛍光を発する分子の分布を可視化する顕微鏡。試料中の目的の分子やタンパク質などを蛍光分子で標識することで、観察対象を高いコントラストで選択的に観察できる。
- 化学固定
パラホルムアルデヒド(ホルマリン)やアルコール類などの化学試薬を用いて、細胞の形態などを固定する手法。
- 蛍光寿命イメージング
蛍光分子は、光を吸収した後、わずかな遅延時間(ナノ秒(10億分の1秒)程度のものが多い)を経て蛍光を発する。この遅延時間は「蛍光寿命」と呼ばれ、蛍光を発する分子の種類によって異なり、その周囲環境・状態によっても変化する。蛍光寿命イメージングとは、蛍光寿命を測定し、マッピングすることで、観察対象の状態変化や分子間相互作用などを解析、可視化する技術。
- 液体イソペンタン−プロパン混合寒剤
イソペンタンと液化したプロパンを混合した極低温の液体寒剤。液体プロパン、液体エタン、液体エタン-プロパン混合寒剤と並び、生体試料を急速凍結する際に用いられる寒剤の1つである。
- 信号対ノイズ比
測定で得られる信号の強度(Signal、S)と、ノイズ成分(Noise、N)の比(S/N)。蛍光顕微鏡などの光計測では、信号は観察対象からの蛍光であり、ノイズには、検出する光子の統計的にランダムなゆらぎ由来するショットノイズや、検出器由来の暗電流ノイズ、読み出しノイズなどが含まれる。Nの値が小さくなるほど、S/Nは大きくなる。
- 光刺激
細胞などの試料に光を照射し、その光照射に応じた応答を誘起する手法。たとえば、光に応じてCa²⁺を放出する試薬(ケージドカルシウム試薬など)を細胞に導入し、その細胞に光を照射すると、特定の部位やタイミングで細胞内カルシウム濃度を変化させることができる。
- ラマン顕微鏡
試料にレーザー光を照射した際に発生するラマン散乱光のスペクトルを計測し、マッピングすることで、特定の分子の空間分布を可視化できる顕微鏡技術。ラマン散乱光とは、分子に光を照射した際に発生する、入射光とは波長の異なる散乱光のことであり、入射光とラマン散乱光のエネルギー差は分子の固有振動数に由来する。このため、ラマン散乱光を計測することで、特定の分子やその状態を非染色で観察できる。

