「顧みられない熱帯病」マイセトーマ 病巣の保護構造形成メカニズムを解明
宿主と原因菌の「鉄の奪い合い」が鍵
研究成果のポイント
- 発展途上国で見られる感染症「マイセトーマ(菌腫)」における菌の塊(グレイン)形成のメカニズムを世界で初めて解明
- マイセトーマ病巣の保護構造を持つグレインは、治療薬となる抗真菌薬の強力な障壁となっているが、生体内でしか形成されないため、その成長過程はこれまで未解明
- 本研究では、昆虫モデルを用いた詳細な分析でグレイン形成過程を解明し、宿主と病原菌の両者における鉄のバランスが病巣の成長に重要な役割を果たしていることを明らかに
- 臨床開発が進んでいなかったマイセトーマ研究におけるマイルストーンであり、治療薬の開発だけでなく、将来的には患部を切除しない負担の軽い治療方法の確立に期待
概要
大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)のイマド アブケセーサ特任教授(常勤)とエラスムス大学メディカルセンターのWendy W.J. van de Sande准教授らの研究グループは、最先端の組織解析技術やオミックス技術、計算生物学の技術などを用いて、マイセトーマのグレインの形成とそのバリア構造の形成機序を世界で初めて明らかにしました(図1)。この発見はマイセトーマの研究における重要なマイルストーンとなります。マイセトーマ自体は1840年の文献にも記載されており古くから知られた疾患ではありましたが、その機序については長い間謎のままでした。マイセトーマに感染した際に作られるグレインは生体でのみ形成されるため、適切な動物モデルや解析技術が必要とされていました。
今回研究グループは、まず、昆虫モデル(Galleria mellonella:蛾の一種)を用いて体内でのグレインの形成過程を観察しました。感染直後から7日後の期間に複数回RNA解析をしたところ、宿主(蛾の幼虫)と病原菌の両者における鉄のバランスが病巣の成長に重要な役割を果たすことが分かりました。また、マイセトーマの病原菌が鉄イオン(III)と強力に結合する「シデロフォア」と呼ばれる物質を分泌し、周囲から集めた鉄を病原菌に取り込む役割を果たしていることを突き止めました。また、宿主内の鉄の量が、菌をグレインの中に封じ込めるか、あるいは外に広がっていくかを左右していることも明らかになりました。この結果は、病巣の成長にとって鉄の取り込みのバランスが重要であることを示唆しており、鉄の供給を阻害することがマイセトーマに対する新たな治療薬となる可能性が示されました。
研究グループは、理化学研究所生命医科学研究センター、エラスムス大学メディカルセンター(オランダ)、アイルランド国立大学メイヌース校、マイセトーマ研究センター(スーダン)で構成される顧みられない熱帯病(特に皮膚疾患)の研究コンソーシアムの中心的役割を担いました。
本研究成果は、英国科学誌「Nature Communications」に、6月25日(水)18時(日本時間)に公開されました。
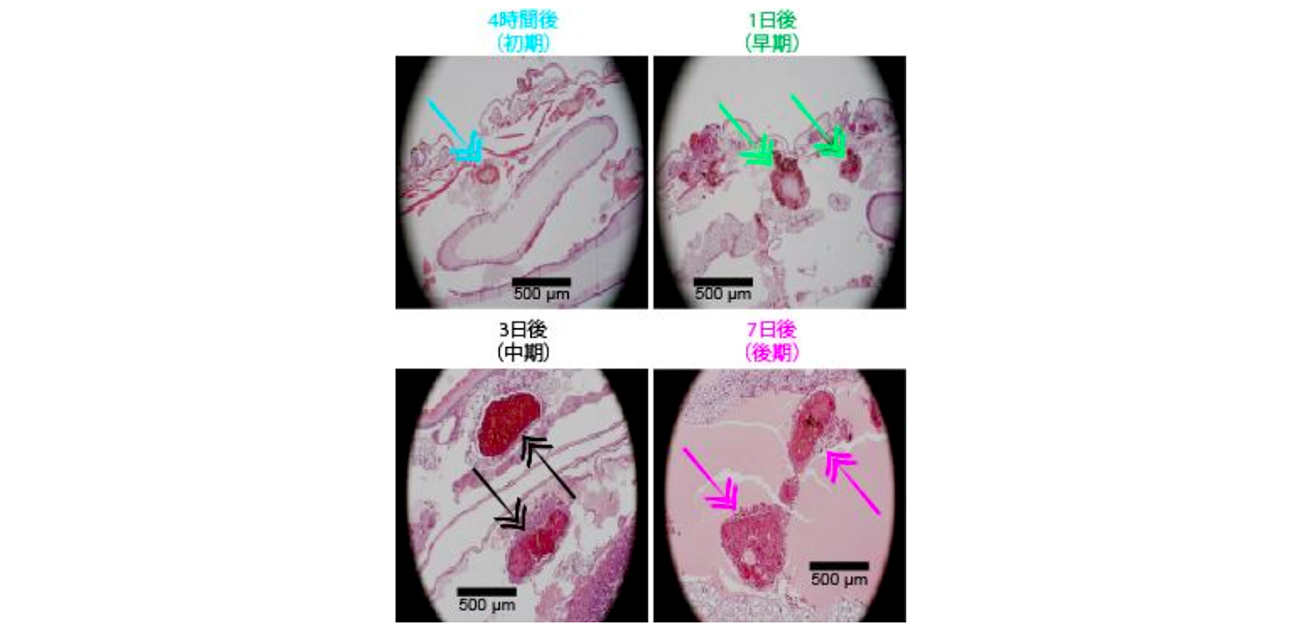
図1. マイセトーマに感染した際に皮下組織に作られるグレインの組織学的観察。感染後7日後までの時間経過を顕微鏡像(倍率40倍)で示した。粒状の構造が形成される過程で、カプセルのような強固な保護構造が形成されていく様子が観察できる。
研究の背景
マイセトーマは進行性の疾患で、長年社会に顧みられていない最貧困層に影響を及ぼすことから、「顧みられない熱帯病」と言われています。この疾患の特徴は、感染した皮下組織に黒い粒状の構造物であるグレインを形成することです(図1)。およそ25-50%の患者が再発し、15%の患者は患部の切断を余儀なくされると言われています。マイセトーマの病巣の周りに作られる保護構造を持つグレインは、この病気の効果的な治療薬でもある抗真菌薬にとって強力な障壁となっています。この保護構造はマイセトーマの特徴ですが、生きた生体内でしか形成されないため、どのように形成されるのかはこれまで解明されていませんでした。そのため、研究グループは、マイセトーマの保護構造の形成の機序を解明することを目指しました。
研究の内容
保護構造の形成の機序を解明するため、研究グループでは昆虫モデル(Galleria mellonellaの幼虫)にマイセトーマの原因菌の一種であるM. mycetomatisを感染させ、時間的変化を観察しました。感染から4時間後、1日後、3日後、7日後の幼虫から抽出されたRNAからトランスクリプトミクス解析を行いました(in vivo観察)。また、組織染色によるグレインの形状や大きさ、数の時間的変化を観察し、幼虫の生存率のモニタリングも行いました(図2)。その結果、鉄の輸送に関わる遺伝子が宿主(トランスフェリンとフェリチン)と病原体(SidA、SidD、Sidi)の両方で顕著に発現していることが明らかになりました。さらに、ネットワーク解析により、M. mycetomatisが持つすべてのシデロフォア関連遺伝子が異なる発現をしていることも分かりました。特に、L-ornithine N(5)-monooxygenase (SidA)、Acyl-CoA ligase (SidI)、Nonribosomal peptide synthetase (SidD)の3つは常に高発現しており、感染から1日後にシデロフォアの経路に関連する他の遺伝子と比べて特に高い発現調節を示しました(図3)。この実験結果を踏まえ、病巣の進行と保護構造の形成に関わると考えられる鉄関連遺伝子の解析を行うことにしました(図2)。病巣は、鉄の恒常性を保つために感染モデル(宿主)の体液(血リンパ)から鉄を得なければならないことから、鉄キレート剤ビピリジン存在下でもホロフェリチンから鉄を獲得できることを確認しました(図3)。さらに、in vitro条件下で病巣のシデロフォア関連遺伝子の発現と産生物について、高度なプロテオミクス解析(タンパク質網羅解析)、およびメタボロミクス解析(代謝物解析)を行いました(図3)。
図4では、感染モデルによる鉄の調節機序を図示しています。健康な宿主では、鉄(Fe²+)が欠乏している場合、鉄応答エレメント結合タンパク質IRP1とIRP2は複合体を形成し、フェリチンのサブユニットLOC13510017(フェリチン)とLOC13510018(フェリチン、EC 1 16 3 1)のコーディングを転写する5’非翻訳領域にある鉄応答性配列と結合し、フェリチンを構成するmRNAの翻訳を阻害します。一方、鉄(Fe²+)が存在する状態では、4Fe-4SクラスターがIRP1に結合し、IRP1/4Fe-4S複合体が鉄応答性配列への結合を妨げるため、フェリチンのサブユニットLOC13510017とLOC13510018の翻訳を促し、フェリチンが生成されます。このフェリチンがFe²+と結合し輸送と保存の役割を担います。感染時には、アコニット酸ヒトラターゼの発現が増加し、それにより4Fe-4Sの合成が促され、IRP1との結合が進み、Fe²+を結合するためのフェリチンサブユニットの翻訳が活性化されて鉄に富んだ環境が整います。一方、病原体側ではFe²+を捕捉するために必要なシデロフォアの合成に関与する遺伝子群の発現を大幅に増加させ、生存に必要な、Fe²+を獲得する戦略をとっていることが判明しました。つまり、宿主と原因菌の間で「鉄の奪い合い」が起こっていることが明らかになったのです。
本研究では、生体内(in vivo)および試験管内(in vitro)で得られたマルチオミクスの時系列データを統合・解析・解釈するための手法を開発しました。この手法により、宿主と病原体の相互作用を関係づけ、感染過程における皮下の腫瘍様構造(マイセトーマ・グレイン)の形成と成長を追跡することが可能となりました。また、非感染性疾患にも広く応用できる汎用性を持つ手法であることから、iPS細胞やオルガノイドを用いた多様なヒト疾患の解明を目指すWPI-PRIMeの研究の発展にも貢献することが期待されます。
図2. 研究の概要図(in vivoとin vitroで得られた、鉄が病巣の形成に及ぼすインパクト)
図3.
左) 感染モデル(宿主)の様々な遺伝子発現の時間的変化
右上)病原体のシデロフォアの時間的変化
右下)鉄関連遺伝子の発現の時間的変化
図4.
上)正常な宿主の鉄の調節機序とフェリチンの生合成
下)感染後のフェリチンの生合成とシデロフォアによる鉄の捕捉
本研究成果が社会に与える影響(本研究成果の意義)
あらゆる感染症の根絶は国連や世界保健機関(WHO)でも重要視されており、「顧みられない熱帯病」であるマイセトーマも例外ではありません。本研究成果はマイセトーマの腫瘍の形成に鉄獲得経路が重要な役割を果たしていることを示唆するものであり、この発見を利用した新たな治療法の開発が期待されます。
特記事項
本研究成果は、2025年6月25日(水)18時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:“Iron regulatory pathways differentially expressed during Madurella mycetomatis grain development in Galleria mellonella”
著者名: Imad Abugessaisa1,2,3, Mickey Konings4, Ri-Ichiroh Manabe5, Cathal M. Murphy6, Tsugumi Kawashima5, Akira Hasegawa1, Chitose Takahashi5, Michihira Tagami5, Yasushi Okazaki5, Kimberly Eadie4, Wilson Lim4, Sean Doyle6, Annelies Verbon4,7, Ahmed H. Fahal8, Takeya Kasukawa1 and Wendy W.J. van de Sande4
1. 理化学研究所生命医科学研究センター生命医科学大容量データ技術研究チーム
2. 大阪大学ヒューマン・メタバース疾患研究拠点
3. 大阪大学大学院医学系研究科
4. Department of Medical Microbiology and Infectious Diseases, Erasmus MC, University Medical Center Rotterdam, Rotterdam, The Netherlands.
5. 理化学研究所生命医科学研究センター応用ゲノム解析技術研究チーム(研究当時)
6. Department of Biology, Maynooth University, Maynooth, Ireland
7. Department of Internal Medicine, University Medical Center Utrecht, The Netherlands
8. Mycetoma Research Center, University of Khartoum, Khartoum, Sudan
DOI:https://doi.org/10.1038/s41467-025-60875-2
なお、本研究は、文部科学省世界トップレベル研究拠点プログラム (WPI)、日本学術振興会科学研究費助成事業(20K08832)、グローバルヘルス技術振興基金(TRP2019-260)、文部科学省、Dutch Research Council、Erasmus University、Research Ireland、そしてEU Horizon 2020 (SECRETED)の研究の一環として行われました。
参考URL
イマド アブケセーサ特任教授(常勤) 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/822b07354dad525f.html
SDGsの目標
用語説明
- マイセトーマ(菌種)
進行性の皮下組織の慢性感染性疾患で、主に発展途上国で見られる疾患。感染は小さな外傷から真菌や細菌が侵入することで起こると考えられており、感染者は裸足で歩く肉体労働者が多い。症状がゆっくりと進行し、痛みもないことから、多くの患者は状態が悪化してから初めて医療機関を受診する。未治療のまま放置すると外科的治療(体の一部を切除)するしかない。
- グレイン
Grain。ここでは、微生物の塊(菌塊)のこと。マイセトーマのグレインは強力な保護構造を有しており、主な治療薬として用いられる抗真菌薬が効きにくくなる原因となっている。
- 「顧みられない熱帯病」
NTD (Neglected Tropical Diseases)と呼ばれる。熱帯地域、特に貧困層を中心に蔓延している感染症の総称であり、1997年のG8でデング熱や狂犬病をはじめ複数の疾患に焦点があてられるようになり、現在WHOにより21の疾患がNTDに指定されている。
- in vivo
「生体内の」という意味で、生体内や細胞内など、条件が人為的にコントロールされていない環境を指す。
- in vitro
「ガラスの中の」という意味で、試験管内など人為的に条件がコントロールされた環境を指す。

