生命現象の本質を探る量子構造生物学の挑戦
地球の窒素循環を担う酵素の反応機構を全原子構造決定により解明
研究成果のポイント
・窒素循環の鍵酵素の反応部位の全原子構造を世界で初めて高精度で決定
・実験(構造情報)と理論(量子化学計算)を統一的につなぐ化学反応機構を提唱
・温室効果ガスの低減や窒素化合物による環境汚染の改善に繋がると期待
概要
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫)量子生命科学領域の玉田太郎グループリーダー、平野優主幹研究員、国立大学法人大阪大学大学院薬学研究科の井上豪教授、福田庸太助教、国立大学法人茨城大学フロンティア応用原子科学研究センターの日下勝弘教授らは共同で、地球の窒素循環の鍵反応を担うタンパク質である銅含有亜硝酸還元酵素(CuNIR) の高精度中性子結晶構造解析 に成功しました。その結果、本酵素中で化学反応が進行する部位(活性中心)に存在する銅イオンに水酸化物イオン が結合した状態を可視化し、これまでの理論的予想が正しいことを示す証拠を初めて得るなど、反応機構の詳細が明らかになりました。
地球の窒素循環において、土壌や水域中の窒素化合物は微生物の働きによって窒素分子へと段階的に変換され、大気中へ放出されます。この地球化学的に重要な過程は脱窒とよばれ、様々な酵素によって担われていますが、なかでも亜硝酸イオンを一酸化窒素ガスに変える反応(亜硝酸還元反応)を行うCuNIRは、脱窒過程の鍵酵素と呼ばれています。この酵素がどのようにしてその反応を行っているのかを理解したいと、世界中の研究者が挑戦してきました。しかしこれまで、量子化学計算 と整合するような原子・電子レベルでの正確な構造を実験的に提示することは出来ていませんでした。これは、従来主に用いられてきたX線結晶構造解析という手法では、CuNIRを構成する原子の約半分を占め、反応に直接関わる水素原子を十分に観測できないことが原因でした。
そこで研究グループは、水素原子を直接観察できる中性子結晶構造解析という手法に着目しました。これを行うためには極めて高品質かつ従来法の1万倍という大きな結晶試料を作成することが必要でしたが、その困難を乗り越え、水素原子も含んだCuNIRの全原子構造を高解像度で決定することに成功しました。その結果、酵素の活性中心に存在する銅イオンには、従来の結晶構造解析の結果から考えられていた水分子ではなく、そこからプロトン(水素原子)一個が取り除かれた水酸化物イオンが結合していることを発見しました。また、亜硝酸還元反応に必要な電子の移動を促進するような仕組み(水素結合 )が、タンパク質内に存在していることも明らかにしました。こうしたことは量子力学を用いた理論研究から予想されていましたが、本研究によって世界で初めて実験的に証明されたことになります。
本研究で得られた知見は、CuNIRによる化学反応を適切に促進/抑制できる技術の開発の基盤となり、この働きを強化した微生物の利用や人工酵素の開発を通じて、将来的に、一酸化二窒素ガス(二酸化炭素をしのぐ温室効果ガス)の低減による大気環境の改善や、肥料として環境中に過剰流入した窒素化合物の低減による土壌・水質汚染の改善が期待できます。また、今回の研究のアプローチは、CuNIRのみならず、あらゆる生物の酵素の働きの理解にも応用できると考えられ、生命現象の本質を極めて正確な立体構造情報に基づいて量子レベルから理解しようとする「量子構造生物学」という領域が切り拓かれることが期待できます。
本研究成果は、Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)誌のオンライン版に2020年2月11日(火)5:00(日本時間)に掲載されました。
研究の背景
生命活動を営むためには、代謝、すなわち膨大な種類の化学反応が必要です。生物も非生物も同じ原子から構成されていますが、生物の本質とは、こうした複数の化学反応をまとめて精妙に制御する能力を持つ点にあると言えます。その主役が酵素と呼ばれるタンパク質です。酵素は極めて小さくかつ精密な分子機械で、これがどのように化学反応を精妙に制御しているのかを理解するためには、その分子の立体構造を原子・電子レベルで正確に決定し、その構造に基づいて、どの部分がどのように動くのか、他の分子にどの部分が作用するのか、どこを電子が流れていくのか、といったことを実験的に計測したり、量子化学による理論計算で予測したりすることが必要です。
酵素は私達人間の体内のあらゆる代謝に関わっているのはもちろん、様々な生物の活動を通じて、地球全体の環境維持の基盤をも担っています。植物による光合成が地球規模での酸素と炭素の循環を生み出しているように、生物にとって必須の元素である窒素の循環でも、実は酵素が主要な役割を果たしています。20世紀以降、人類の活動によって環境中へ過剰流入した窒素化合物が、自然の持つ窒素循環の均衡を脅かし、土壌や水質の汚染を引き起こしているという問題があります。土壌中や水中の窒素化合物は主に、微生物が行う脱窒という働きによって窒素ガスにまで段階的に再変換され、大気中へと戻されます (図1) 。従って、この脱窒過程に関わる化学反応について深く理解することは、大気・水質環境や農業環境の改善につながると期待できます。脱窒に関わる酵素のなかでも、亜硝酸イオン(NO 2 - )を一酸化窒素ガス(NO)に変換する亜硝酸還元酵素は、脱窒における鍵酵素と呼ばれています。これは、この反応によって窒素化合物がガスとなって土壌を去り、生物が栄養として利用できない形になるだけでなく、生成するNOは二酸化炭素をしのぐ温室効果ガスである一酸化二窒素(N 2 O)の前駆体であり、本反応の制御が地球温暖化に歯止めをかける一つの手段として、地球環境にとって極めて重要と目されているためです。
このような背景から、亜硝酸還元酵素の一種である銅含有亜硝酸還元酵素(CuNIR)について、過去30年以上にわたり、様々な研究グループが反応機構解明に取り組んできました。特に、本酵素の立体構造を知るために、X線結晶構造解析が精力的に行われてきました。しかしながら、これまでの結晶構造解析に基づいて提案されていた反応機構と、量子力学を用いた理論計算から予想される反応機構との間には大きな違いがあり、議論が続いていました。この原因は、「水素原子」の観測がX線結晶構造解析では原理的に困難である点にありました。タンパク質を構成する原子の約半数が水素原子であり、タンパク質を取り巻く水分子にも水素原子が含まれます。さらに、CuNIRによる化学反応は、亜硝酸イオンへ水素イオンが渡される過程を含むため、水素原子を正確に観測することなしには、反応機構の詳細に迫ることができないと考えられていました。
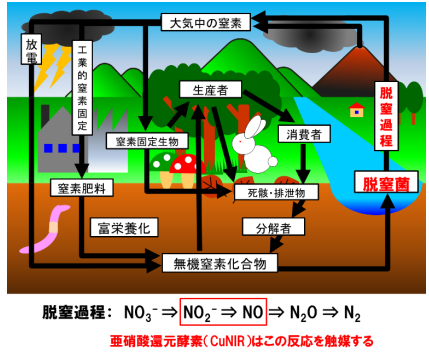
図1 環境中の窒素循環と脱窒過程
CuNIRは脱窒過程中の赤枠の反応を進める酵素
研究の内容
そこで、研究グループは、水素原子の観測に優れるという特色を持つ「中性子結晶構造解析」に着目しました。しかしこの手法は、計測試料となるタンパク質の結晶の調製に非常に高度な技術を必要とします。2019年に英国と日本の合同研究グループがある種のバクテリア由来のCuNIRについて中性子結晶構造を報告していますが、化学反応が進む酵素の部位(活性中心)に存在する多くの水素原子のシグナルがはっきりしていないという問題がありました。
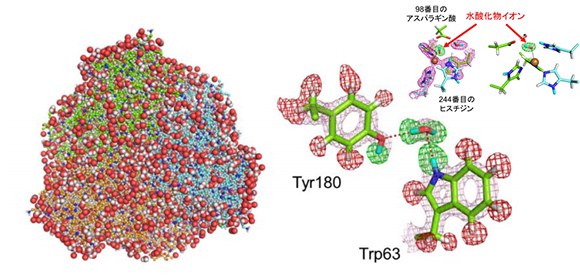
研究グループはこれまでに実施したCuNIR研究を通じて蓄積した知見から、 Geobacillus thermodenitrificansというバクテリア由来のCuNIRの結晶が優れた性質(高い分解能を示す)を有することに着目し、この性質により上記の問題点を解決できると考えました。続いて、中性子はX線に比べるとビームの強さが格段に弱いため、中性子結晶構造解析のためには通常X線結晶構造解析で用いる結晶の約1万倍の大きさの結晶を作る必要があります。研究グループは、これまでに他の研究試料の中性子結晶構造解析に複数成功しており、その際に得た知見を活かしてCuNIRの高品質な大型結晶を作製し、さらに結晶の質を劣化させることなく測定条件(低温状態)に移行することに成功しました。中性子回折データ収集は、大強度陽子加速器施設(J-PARC)の物質・生命科学実験施設(MLF)内にある茨城県生命物質構造解析装置(iBIX) を用いて行いました。iBIXはパルス中性子の特徴を活かした精度良い回折データ収集が可能な装置で、データの完全性が99.7%という良質なデータの収集に成功しました。さらに、同一結晶から放射光施設(高エネルギー加速器研究機構のフォトンファクトリーアドバンストリング)においてX線回折データを収集し、それを組み合わせた構造精密化によって、最終的に1.5Å分解能(1オングストロームは100億分の1メートル)という非常に高い分解能でCuNIRの立体構造を決定しました (図2) 。
得られた構造を観察することにより、活性中心周囲に存在するアミノ酸や水分子上の水素原子の位置をすべて特定することに世界で初めて成功しました。この全原子構造から、亜硝酸イオンへの水素イオンの運搬で中心的役割を果たす2つのアミノ酸についての情報が得られました。すなわち、98番目のアスパラギン酸には水素が付いておらず(脱プロトン化状態)、244番目のヒスチジンには水素が付いている(プロトン化状態)ことが明らかになりました。これらはこれまでに報告された実験結果や量子化学計算の結果とよく一致していました。
さらに、活性中心である銅イオンの上に存在する水分子のひとつについて、水分子であれば2つ存在するはずの水素原子が1つしか観察できないことがわかりました。これは、水分子からプロトン(水素原子)がひとつ外れて水酸化物イオン(OH - )になっている化学種が存在することを示しています (図3) 。水分子と水酸化物イオンはわずか水素原子ひとつ分の違いしかなく、X線を用いて区別することは極めて困難です。今回の研究は、良質な大型結晶作製という生化学実験と中性子を用いた解析という物理学実験をうまく組み合わせた構造解析技術により、初めて成し得た成果と言えます。今回、研究グループは酸性条件下で作製した結晶を使用しました。酸性条件下では水素イオン(H + )濃度が高いため、水酸化物イオンはH + +OH - →H 2 Oという反応によって、水素イオンを得て容易に水分子となるはずですので、本結果は、CuNIRが、酸性環境下でさえ水酸化物イオンが安定的に存在できるという、通常の水溶液中では起こりえない環境をその活性中心で可能にしていることを示しています。
これまで、X線結晶構造解析の結果に基づき、多くの実験科学者たちは、「亜硝酸イオンが水素イオンを得た後、水が解離し、NOが結合した銅イオンが活性中心に残される」という反応機構を提唱してきました (図4上) 。しかし、NOが結合した銅イオンは反応性の高い化学種であるため、CuNIR自身を攻撃し、不活性化してしまう可能性があります。一方、理論科学者たちは量子化学計算を用いて、「亜硝酸イオンが水素イオンを得た後、NOが解離し、水酸化物イオンの結合した銅イオンが活性中心に残される」という反応機構を提唱してきました (図4下) 。ただ、銅イオンに水酸化物イオンが結合した構造がCuNIR中で本当に安定して存在できるかどうか、実験的証拠は得られていませんでした。今回の研究グループの結果は、銅イオンに水酸化物イオンの結合した構造がCuNIR中で安定に存在できることを示しており、後者の反応機構を支持するものと言えます。
もうひとつの知見として、量子化学計算によって予想されていたタンパク質内電子移動経路に関するものがありました。CuNIRは分子表面から電子を受け取り、この電子がタンパク質内部を流れ、活性中心の銅イオンへと移動します。量子化学計算を用いた研究から、電子移動経路には水素結合が存在すると予想されていましたが、実験的な証拠はありませんでした。今回、研究グループは、水素と重水素を明確に見分けられるという中性子の特長を活かした水素-重水素置換法 を用い、活性中心の銅イオンと結合しており電子移動反応経路上にある134番目のヒスチジンが形成する水素結合に関して、重水素置換効率が低いことを見出しました (図5) 。これはこの水素が関与する水素結合が強固であることを示しています。強固な水素結合はこの上を流れる電子の移動に有利に働いていると考えられます。CuNIRが担う化学反応において、この電子移動はその土台を支える非常に重要な機構ですが、今回観測した強固な水素結合は中性子を用いた研究ならではの成果と言えます。

図2 CuNIRの中性子結晶構造
左が全体構造(水素原子位置は白い玉で表示)。右は部分構造を抜き出したもの。水素原子(赤)や重水素原子(緑)のシグナル(原子核散乱長密度分布:網目)がはっきりと見える。実験には重水を用いているため、水分子として重水分子を観察しており、アミノ酸中の水素原子も一部重水素原子に置き換わっている。
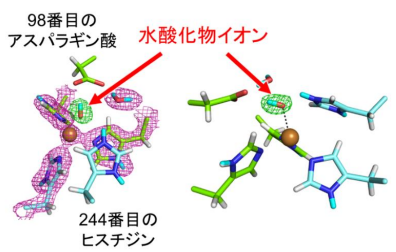
図3 CuNIR中で観察された銅イオン(茶色球)に結合した水酸化物イオン
白色および濃い水色はそれぞれ水素、重水素原子を示す。左と右は異なる方向から見た図。網目は原子核散乱長密度分布で緑色は水酸化物イオンを除いて計算したもの。隣の赤紫色の水分子(D 2 O)とは形が明確に異なることが分かる。
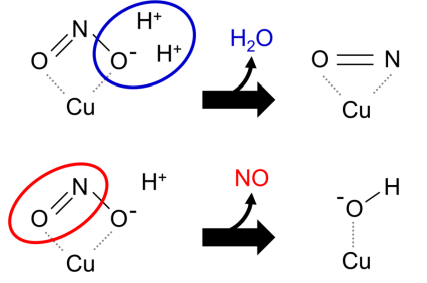
図4 CuNIRの推定反応機構
上はX線結晶構造に基づいて従来考えられていた機構。亜硝酸イオン(NO 2 - )が水素イオン(H + )を得て、水分子が解離し、NOが銅イオン(Cu)の上に残る。下は量子化学計算が支持する機構。亜硝酸イオンが水素イオンを得て、NOが解離し、水酸化物イオン(OH - )が銅イオン(Cu)の上に残る。今回の中性子結晶構造解析の結果は下の機構を支持した。

図5 134番目のヒスチジン(His134)は強固な水素結合を有する
His134はN ε 原子を介して活性中心の銅イオンと結合している。同様にN ε 原子を介して活性中心の銅イオンと結合している他のヒスチジン(His100やHis294)のN δ 原子上の水素原子は完全に重水素原子に置換されていた。一方、His134のN δ 原子上の水素原子は重水素交換率が低く一部が水素のまま残っていた(原子核散乱長密度分布のピンク色と赤色はコントラストの違いを示す)。
研究の成果と今後の期待
今回、高分解能中性子結晶構造解析により取得した精密な全原子構造情報を用いて、CuNIRの活性中心の銅イオンに水酸化物イオンが結合した状態を可視化し、量子化学計算により予想された化学反応機構が正しいことの実験的証拠を世界で初めて示しました。さらに、タンパク質内電子移動経路に関するデータから、脱窒過程の鍵酵素であるCuNIRの反応機構についての詳細がより明らかになりました。これらは、今まで矛盾が散見されていたCuNIRに関する実験(結晶構造解析)と理論計算(量子化学計算)とをシームレスに繋ぐものであり、「原子」から「量子」レベルの生命現象の理解に一歩近づいた成果であると言えます。
また、今回の成果は、水素イオンや電子の移動といった、CuNIR中で進行する化学反応の各段階を適切に促進あるいは制御できる技術の基盤となり得るものであり、脱窒作用の働きを強化した微生物の利用や、人工酵素の開発といった産業応用にもつながると考えられます。したがって、将来的には、二酸化炭素をしのぐ温室効果ガスである一酸化二窒素ガスの低減による大気環境の改善ひいては地球温暖化の軽減に、あるいは、肥料として環境中に過剰流入した窒素化合物の低減による環境汚染の改善が期待できます。
さらに、CuNIRの反応のように電子と水素イオンの移動が同時に関わる化学反応は、光合成や呼吸をはじめ、地球上の全生物の代謝において普遍的に見られる現象です。今回の研究で、こうした生命現象の根幹をなす重要な化学反応の理解には、水素原子の直接観測に長けている中性子構造解析が非常に有効であることが明らかになりました。今後、今回の研究で蓄積したノウハウを活かし、生命現象の本質を量子レベルから理解しようとする「量子構造生物学」という領域を切り拓くことを目指していきます。
本研究は、文部科学省科学研究費補助金若手研究(B)(研究代表者:福田庸太)および基盤研究(B)(研究代表者:井上豪)の補助を受けたものです。中性子回折実験は茨城県中性子ビームライン県プロジェクト研究(現:茨城県中性子ビームラインBL利用促進課題、研究代表者:福田庸太)において、大強度陽子加速器施設(J-PARC)の物質・生命科学研究施設(MLF)の茨城県生命物質構造解析装置(iBIX)を用いて実施し、X線回折実験は高エネルギー加速器研究機構(KEK)のフォトンファクトリーアドバンストリング(研究代表者:玉田太郎)にて実施しました。
論文掲載情報
掲載誌:「Proceedings of the National Academy of Sciences of the United States of America」
論文タイトル:High-resolution neutron crystallography visualizes an OH - bound resting state of a copper containing nitrite reductase
著者:Y. Fukuda, Y. Hirano, K. Kusaka, T. Inoue, and T. Tamada
DOI:www.pnas.org/cgi/doi/10.1073/pnas.1918125117
参考URL
大阪大学大学院薬学研究科創成薬学専攻 生体構造機能分析学分野 井上研究室
http://www.phs.osaka-u.ac.jp/homepage/b027/index.html
用語説明
- 量子化学計算
化学物質を形づくる化学結合には電子が関与しており、多くの化学反応ではこの化学結合の組み換えがおこなわれます。したがって、化学反応の詳細を知るためには、電子の振る舞いを知ることが重要ですが、電子のような微視的な世界における現象を扱うためには、量子力学を用いねばなりません。量子化学計算は、量子力学に基づいて、化学物質を構成する電子の振る舞いを予測し、その物質の構造や反応性を理論的に予測するための計算です。
- 銅含有亜硝酸還元酵素(CuNIR)
亜硝酸イオンを一酸化窒素へ一電子還元する反応(NO 2 - +2H + +e - →NO+H 2 O)を触媒する酵素で、自然界の様々な微生物に広く見つかっています。CuNIRは同じ構造を持つ単量体3つからなる3量体構造を取り、各単量体あたり2つの銅イオンを含んでいます。このうち片方の銅イオンが触媒反応の行われる活性中心を形成しています。
- 結晶構造解析
分子の詳細な立体構造を決定するための実験手法。結晶試料に中性子やX線などのビームを照射し、結晶によって回折(散乱)されたビームを、検出器を用いて測定し、その回折強度分布から計算によって分子の立体構造を導くことができます。中性子とX線を用いた結晶構造解析をそれぞれ中性子結晶構造解析とX線結晶構造解析と言います。X線は原子の有する電子と相互作用するため、水素のような原子番号が小さく電子数が少ない原子からのX線回折強度は弱く、水素原子位置の観察が困難です。一方、中性子は原子核と相互作用し、回折強度は相互作用の強さを反映するため、タンパク質を構成する他の元素(炭素、窒素、酸素)と遜色なく水素原子を観察できます。
- 水酸化物イオン
水(H 2 O)が電離すると、プラスの電荷を帯びた陽イオンである水素イオン(H + というイオン式で表され、プロトンともいう)と、マイナスの電荷を帯びた陰イオンである水酸化物イオン(OH - というイオン式で表れる)になります。水酸化物イオンは様々な物質と結合し、化合物を作ります。
- 水素結合
水素原子が他の原子と結合を作ると、一般的に電気的に弱いプラスの性質を持ちます。電気的に弱いプラスの性質を持った水素原子は、その周囲にある弱いマイナスの性質を持った原子と相互作用することができ、これを水素結合と呼びます。分子量の小さい水が100℃という高い沸点を示すのは、比較的強い相互作用である水素結合によって水分子どうしがネットワークを形成しているためです。また、水素結合は生体物質に取っても欠かせない相互作用で、例えばタンパク質やDNAの立体構造を保つなど重要な働きをしています。
- 茨城県生命物質構造解析装置(iBIX)
茨城県が大強度陽子加速器施設(J-PARC)の物質・生命科学実験施設(MLF)に設置した2本の中性子ビームラインのうちの一つです。J-PARCは日本原子力研究開発機構(JAEA)と高エネルギー加速器研究機構(KEK)が共同で運営している加速器実験施設で、MLFでは加速した陽子が水銀に当たって発生する中性子を使っています。iBIXはJ-PARCMLFの強力なパルス中性子源に対応して,最大限の成果が得られるように高感度の検出器を34台(研究実施時は30台)配置した世界初のパルス中性子源用単結晶中性子回折装置です。
- 水素-重水素置換法
結晶中に存在する水素原子の一部を水素の安定同位体である重水素原子に置き換える手法。これは、中性子結晶構造解析を行う前に、重水素を含む溶液に結晶を長時間浸すことでおこないます。重水素に置き換わりにくい水素は周囲の原子と強固な水素結合を形成していると考えられています。また、中性子の原子核散乱長密度分布は水素では負、重水素では正のシグナルとして観察できますので、水素と重水素を明確に識別することが可能です。
