全ゲノムシークエンス解析で日本人の適応進化を解明
アルコール・栄養代謝に関わる遺伝的変異が適応進化の対象
概要
理化学研究所(理研)生命医科学研究センター統計解析研究チームの鎌谷洋一郎チームリーダー、大阪大学大学院医学系研究科遺伝統計学の岡田随象教授、慶應義塾大学医学部百寿総合研究センター の広瀬信義特別招聘教授、同臨床遺伝学センターの小崎健次郎教授らの共同研究グループ は、日本人集団2,200人の全ゲノムシークエンス解析 を行い、日本人集団の適応進化 に関わる遺伝子領域を同定しました。
生物の性質が、世代を経るごとに周囲の環境に対応して変化する現象を、適応進化と呼びます。適応進化の過程では、生物の設計図であるゲノム配列 の多様性に変化が生じます。そのため、ヒト集団におけるゲノム配列の多様性を調べることで、ゲノム配列上のどの遺伝子領域が環境の変化に適応し、その集団が遺伝学的に進化してきたかを知ることができます。
今回、共同研究グループは、バイオバンク・ジャパン および慶應義塾大学医学部百寿総合研究センターにより収集された日本人集団2,200名を対象に、ゲノム配列情報に基づく適応進化の解析を行いました。全ゲノムシークエンス解析を行い、集団中に低頻度で存在する遺伝的変異の分布を検討することで、過去数千年間において適応進化の対象となっていた四つの遺伝子領域を同定しました。また、これらの遺伝的変異は日本国内の各地域(特に沖縄地方)で異なる頻度を持つことが明らかになりました。
さらに、日本人集団において知られている、病気の発症や臨床検査値 に影響を与える遺伝的変異において、適応進化の強さを調べたところ、飲酒量などアルコール代謝と、脂質や血糖値、尿酸値など栄養代謝に関わる形質に影響を与えている遺伝的変異が、日本人集団の適応進化の主な対象となっていたことが分かりました。これは、他の人類集団とは異なる結果であり、日本人集団に特有の適応進化が存在したことを示唆する結果です。
本成果は今後、日本人の歴史の解明や、遺伝的背景を考慮した健康の増進に寄与すると考えられます。また、より大規模な全ゲノムシークエンスデータが構築されることで、さらなる適応進化の解明が期待できます。本研究成果は、英国のオンライン科学雑誌『Nature Communications』(4月24日付け)に掲載されました。
本研究における全ゲノムシークエンス情報は、科学技術振興機構(JST)バイオサイエンスデータベースセンター(NBDC)および、理化学研究所生命医科学研究センター統計解析研究チームが構築した日本人集団ゲノム関連解析情報データベース「Jenger」 注1) を通じて公開されました。
本研究は、日本医療研究開発機構(AMED)の「オーダーメイド医療の実現プログラム」の支援のもと行われました。
注1) Japanese ENcyclopedia of GEnetic associations by Riken (Jenger).
http://jenger.riken.jp/
※ 共同研究グループ
理化学研究所
生命医科学研究センター
副センター長(研究当時)久保 充明(くぼ みちあき)
副センター長 山本 一彦(やまもと かずひこ)
統計解析研究チーム
チームリーダー 鎌谷 洋一郎(かまたに よういちろう)
特別研究員 石垣 和慶(いしがき かずよし)
客員研究員 秋山 雅人(あきやま まさと)
研修生 坂上 沙央里(さかうえ さおり)
(東京大学大学院医学系研究科 博士課程)
研修生 金井 仁弘(かない まさひろ)
(米国ハーバード大学医学部 博士課程)
基盤技術開発研究チーム
チームリーダー 桃沢 幸秀(ももざわ ゆきひで)
大阪大学大学院医学系研究科 遺伝統計学
教授 岡田 随象(おかだ ゆきのり)
大学院生 岸川 敏博(きしかわ としひろ)
慶應義塾大学医学部
臨床遺伝学センター
教授 小崎 健次郎(こさき けんじろう)
百寿総合研究センター
特別招聘教授 広瀬 信義(ひろせ のぶよし)
専任講師 佐々木 貴史(ささき たかし)
専任講師 新井 康通(あらい やすみち)
慶應義塾大学
客員教授 末松 誠(すえまつ まこと)
東京大学大学院 新領域創成科学研究科 クリニカルシークエンス分野教授
松田 浩一(まつだ こういち)
背景
生物の性質が、世代を経るごとに周囲の環境に対応して変化していく現象を、適応進化と呼びます。適応進化の過程では、生物の設計図であるゲノム配列の多様性に変化が生じています。適応進化は地球上の多彩な生物で認められる現象です。現生人類(ホモ・サピエンス)であるヒトにおいても、ヒト集団内においてゲノム配列の多様性がどのように変化してきたかを調べることで、ゲノム配列上のどの遺伝子領域が、どのような適応進化の対象となっていたかを知ることができます。
ヒト集団の適応進化の過程は、その集団における生活環境や地理的条件に応じて異なることが知られています。これまでに、ヨーロッパ大陸の欧米人集団では寒い北方の地に進出する過程で身長が高くなった、高所に住むチベット人集団では低酸素環境への適応が進んだ、アフリカ人集団ではマラリアなどの病原体への感染防御が進んだ、といった報告がなされてきました。しかし、日本人集団における適応進化については、どの遺伝子領域を中心に、どのような環境が原因となって進んできたのか、よく分かっておらず、日本人集団における大規模ゲノム情報を用いた解析の実施が望まれていました。
研究手法と成果
共同研究グループはまず、バイオバンク・ジャパンおよび慶應義塾大学医学部百寿総合研究センターにより収集された日本人集団2,200名を対象に、ゲノム配列情報に基づく適応進化の解析を行いました。ヒトゲノムの全塩基配列を解読する全ゲノムシークエンス解析を大規模かつ高深度に実施したことで、通常のゲノム解析では見落とされていた、集団中に低頻度で存在する遺伝的変異の解析が可能になりました。これは、欧米人集団以外で論文報告された高深度全ゲノムシークエンス解析として最大規模の成果になります。
全ゲノムシークエンス解析の結果、日本人集団で過去数千年間において適応進化の対象となっていた四つの遺伝子領域(ADH1B遺伝子、MHC領域、ALDH2遺伝子、SERHL2遺伝子)を同定することに成功しました (図1) 。
適応進化に関わる遺伝的変異は、各地域における生活環境や地理的条件の影響を受けるため、同じ集団内であっても地域ごとに遺伝的変異頻度が異なることが知られています。次に、バイオバンク・ジャパンを通じて日本全国から集められた17万人のゲノムワイド関連解析(GWAS) のデータを用いて、本研究で同定した日本人集団の適応進化に関わる遺伝的変異の頻度を調べました。その結果、これらの遺伝的変異は日本国内の各地域で異なる頻度を持っており、特に沖縄地域で最も異なる頻度を示すことが明らかになりました (図2) 。
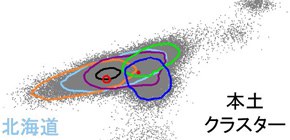
これらの結果は、日本人集団における適応進化の関わり方や遺伝的背景が、日本国内の各地域において異なっていることを示すものと考えられました。そこで、17万人のゲノムワイド関連解析のデータに対して主成分分析 を行い、各サンプルの遺伝的背景をおおまかに分類したところ、日本人集団を大きく二つのクラスター(本土クラスターと琉球クラスター) 注2) に分類できることが明らかになりました (図3) 。
さらに、日本人集団の適応進化に影響を与えた形質について調べました。これまでに報告されている、日本人集団において病気の発症や臨床検査値の個人差に影響を与える遺伝的変異 注3) 注4) において、適応進化の強さを網羅的に検討しました。その結果、飲酒量などアルコール代謝と、脂質や血糖値、電解質、タンパク質、尿酸値や痛風など栄養代謝に関わる形質に影響を与えている遺伝的変異が、日本人集団の適応進化の主な対象となっていたことが分かりました。これは、他の人類集団で観察された適応進化とは異なる結果であり、日本人集団に特有の適応進化が存在したことを示す結果です (図4) 。
ホモ・サピエンスのヒトゲノム配列の中には、既に絶滅した他のヒト属由来のゲノム配列が混入していることが知られています。絶滅したヒト属であるネアンデルタール人 由来のヒトゲノム配列における適応進化の強さについても検討しましたが、明らかな適応進化の影響は確認されませんでした。ネアンデルタール人由来のヒトゲノム配列は、適応進化を経て現代人の一部の疾患の原因となっているという説が提唱されていますが 注5) 、本研究においては必ずしも合致しない結果となり、今後のさらなる検討が必要と考えられます (図5) 。
注2) 2008年9月26日プレスリリース「1人あたり約14万個所のDNA塩基多型を用いて日本人の集団構造を解明」
http://www.ims.riken.jp/pdf/20080926_1.pdf
注3) 2017年9月12日プレスリリース「肥満に影響する遺伝マーカーを解明」
http://www.riken.jp/pr/press/2017/20170912_1/
注4) 2018年2月6日プレスリリース「58の臨床検査値に影響する遺伝的背景を解明」
http://www.riken.jp/pr/press/2018/20180206_1/
注5) Sankararaman, S. et al. The genomic landscape of Neanderthal ancestry in present-day humans. Nature 507, 354-357(2014).
図1 日本人集団の適応進化に関わる遺伝子領域
日本人集団2,200名の全ゲノムシークエンス解析により、日本人集団の適応進化に関わる遺伝子領域(ADH1B遺伝子、MHC領域、ALDH2遺伝子、SERHL2遺伝子)が明らかになった。横軸に染色体上の位置、縦軸に各遺伝的変異における適応進化の強さを示した。
図2 日本人集団の適応進化に関わる遺伝的変異の各地域における頻度分布
日本人集団の適応進化に関わる四つの遺伝的変異の集団内の頻度が、日本の各地域において異なっていることが明らかとなった。特に、沖縄地域で最も異なる頻度が観察された。赤から紫にいくに従って、高頻度であることを示している。
図3 遺伝的背景に基づく日本人集団の分類
日本人集団17万人のゲノムワイド関連解析データに対して主成分分析を行い、遺伝的背景に基づくサンプルのおおまかな分類を行った。その結果、日本人集団が、本土クラスターと琉球クラスターの二つに分類されることが明らかとなった。
図4 日本人集団で病気や臨床検査値に影響を与える遺伝的変異における適応進化の強さ
ゲノムワイド関連解析(GWAS)を通じて報告されている、日本人集団において病気の発症や臨床検査値の個人差に影響を与える遺伝的変異を対象に、適応進化の強さを検討した。飲酒量などアルコール代謝と、脂質(HDL・LDLコレステロール値)や血糖値、電解質(カリウム・ナトリウム)、タンパク質、尿酸値や痛風など栄養代謝に関わる形質が、日本人集団の適応進化の主な対象となっていた。身長や免疫応答反応(CD8+ T細胞遺伝子発現量調節効果)など、他の人類集団で適応進化の対象となった形質も認められたが、その影響は相対的に小さかった。
図5 ネアンデルタール人由来のヒトゲノム配列における適応進化の強さ
ヒトゲノム配列の数%程度に、絶滅したヒト属であるネアンデルタール人由来のゲノム配列が混入している。3種類のデータベースからネアンデルタール人由来のヒトゲノム配列情報を取得した。ネアンデルタール人由来のヒトゲノム配列とそうでない配列との間で、日本人集団における適応進化の強さを比較したが、統計学的に有意な影響は確認できなかった。
今後の期待
本成果は、大規模全ゲノムシークエンス解析により日本人集団における適応進化に関わる遺伝子領域や、遺伝的背景の構造化、適応進化の対象となる形質を明らかにしたものです。他の人類集団における報告と異なり、アルコール代謝や栄養代謝に関わる遺伝的変異が日本人集団の適応進化の主な対象であったことは、日本人の歴史の解明や、遺伝的背景を考慮した健康の増進に寄与すると考えられます。また、高深度の全ゲノムシークエンス解析が、適応進化の解明の強力なツールとなることを示した、画期的な成果と考えられます。今後、より大規模な全ゲノムシークエンスデータが構築されることで、さらなる適応進化の解明が期待できます。
論文情報
<タイトル>
Deep whole-genome sequencing reveals recent selection signatures linked to evolution and disease risk of Japanese
<著者名>
Yukinori Okada, Yukihide Momozawa, Saori Sakaue, Masahiro Kanai, Kazuyoshi Ishigaki, Masato Akiyama, Toshihiro Kishikawa, Yasumichi Arai, Takashi Sasaki, Kenjiro Kosaki, Makoto Suematsu, Koichi Matsuda, Kazuhiko Yamamoto, Michiaki Kubo, Nobuyoshi Hirose, and Yoichiro Kamatani.
<雑誌>
Nature Communications
<DOI>
10.1038/s41467-018-03274-0
参考URL
大阪大学 大学院医学系研究科 遺伝統計学
http://www.sg.med.osaka-u.ac.jp/index.html
用語説明
- 慶應義塾大学医学部百寿総合研究センター
日本における長寿医療研究の拠点の一つ。25年にわたる慶応義塾大学医学部における百寿者研究をもとに創設された。主に105歳以上の百寿者(100歳以上の人物)やスーパーセンテナリアン(110歳以上の人物)を対象としている。世界最大規模の高齢な百寿者のバイオリソース(ゲノム情報やエピゲノム情報)を持つ。対象者の詳細な老化形質の収集を行っている。これらの試料を元に健康長寿要因の解明を目指している。
- 全ゲノムシークエンス解析
ヒトゲノムを構成する30億の塩基配列を解読するゲノム解析技術。次世代シークエンサー(NGS)技術の発達により、2017年現在、1サンプルあたり約10万円以下のコストでの実施が可能になっている。
- 適応進化
生物の性質が、世代を経るごとに周囲の環境に対応して変化していく現象。ゲノム配列上に生じた遺伝的変異が、周囲の環境に適用して生存が有利となった個体を中心に集団内で拡散していくことで、集団内におけるゲノム配列の多様性に変化が生じる。
- ゲノム配列
生物の設計図。アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類の塩基が連なった塩基配列として、細胞内に保存されている。ゲノム配列の長さは生物種によって異なり、ヒトにおいては約30億の塩基配列で構成されている。
- バイオバンク・ジャパン
日本人集団27万人を対象とした生体試料バイオバンクで、ゲノム解析が終了した人数は約20万人とアジア最大である。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へのデータ提供や分譲を行っている。
- 臨床検査値
健康状態や病気の状況を把握する目的で、健康診断や医療現場で実施される医学検査結果の数値。代表的なものとして、採血による血液検査や生化学検査、生理機能検査が挙げられる。
- ゲノムワイド関連解析(GWAS)
ヒトゲノムの全域に分布する数百万カ所の遺伝的変異の情報を袖手し、臨床検査値や病気との因果関係を網羅的に検討する遺伝統計解析手法。これまでに、数百を超える形質や病気を対象に実施され、数多くの関連遺伝的変異が同定されている。GWASはGenome-Wide Association Study の略。
- 主成分分析
多数の変数で構成されるデータから、そのデータの特徴を表す代表的な変数(主成分ベクトル)を抽出する多変量解析技術。多人数のヒトゲノムデータに対して主成分分析を実施することで、各サンプルの遺伝的背景や出身地域を推定することができる 注2) 。
- ネアンデルタール人
既に絶滅したヒト属の一種。地球上に数十万年前から数万年前まで生息していた。同じくヒト属に含まれる現生人類(ホモ・サピエンス)とは別の生物種であるが、ネアンデルタール人由来のゲノム配列がヒトゲノム配列の一部に混入していることより、過去においてネアンデルタール人と現生人類との接触があったと考えられている。
