制御性T細胞が大腸がんの進行に関与していた!
腸内細菌のコントロールによる大腸がん治療に期待
本研究成果のポイント
・免疫細胞の一種である制御性T細胞 が大腸がんに対する免疫を弱めることを解明
・逆に、大腸がんの周辺に存在するFOXP3 を弱発現 する細胞群は、がん免疫を促進することを発見
・FOXP3を弱発現する細胞群の誘導にはある種の腸内細菌が関与していることから、将来、腸内細菌を調整することによる大腸がん治療の可能性に期待
概要
大阪大学免疫学フロンティア研究センターの西塔拓郎博士、西川博嘉准教授、坂口志文教授らの研究グループは、大腸がんの組織内部の深くまで進行したリンパ球において、従来、制御性T細胞と見なされていたFOXP3陽性細胞の中に、FOXP3を弱発現する細胞群が多数存在し、がん免疫を促進することを明らかにしました。また、この細胞群は、免疫を抑制する能力を持たない活性型T細胞であり、大腸がんに付着する腸内細菌により腫瘍内で増加したIL-12などの炎症性のサイトカイン によって誘導されることを解明しました (図) 。さらに、この様なFOXP3を弱発現する細胞群が多数浸潤 する大腸がんは予後(治療後の経過)が良好である一方、抑制活性をもつ制御性T細胞が多数浸潤する大腸がんは他のがん腫と同様に、制御性T細胞の浸潤が予後不良の原因になることを示しました。
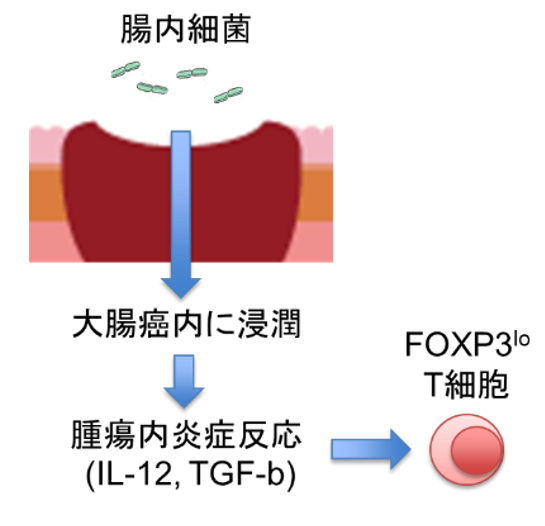
図
腸内細菌が腫瘍に浸潤することで腫瘍内炎症反応を惹起し、FOXP3を弱発現する活性化T細胞を誘導し、腫瘍免疫を亢進する
がん免疫治療において抗腫瘍免疫に働く細胞群として、制御性T細胞は大きな注目を集めており、この細胞群による免疫抑制をコントロールすることは、がん免疫治療をより効果的にするために必須のものであると考えられています。
本研究成果により、未だ一部の腫瘍でしか、がん免疫療法の効果が認められなかった大腸がんにおいて、制御性T細胞を標的としたがん免疫療法の可能性が示唆されました。また、腸内細菌が腫瘍内炎症を介して腫瘍免疫を高める可能性があることが示され、腸内細菌のコントロールによる大腸がん治療への応用の可能性が期待されます。
なお、本研究成果は4月26日(火)午前0時(日本時間)に「Nature Medicine」に掲載されました。
研究の背景
近年、抗PD-1 抗体薬や抗CTLA-4 薬などの免疫チェックポイント分子阻害薬 の出現により、がん免疫治療は劇的な進歩を遂げています。免疫チェックポイント分子阻害薬出現前には5年生存がほぼ期待できなかった悪性黒色腫患者において、これらの治療薬を使用することにより、5年生存率が約40%を越えるまで期待されることが報告されました。しかしながら、これらの治療薬が臨床効果をもたらす仕組みについては、未だ不明な部分が多く残されています。
がん免疫治療において抗腫瘍免疫に働く細胞群として、制御性T細胞は大きな注目を集めており、この細胞群による免疫抑制をコントロールすることは、がん免疫治療をより効果的にするために必須のものであると考えられています。制御性T細胞は、FOXP3をマスター遺伝子(その機能に必須となる遺伝子)として免疫抑制を司る細胞で、腫瘍内において種々の抗腫瘍免疫応答を抑制することにより、がんが免疫系からの攻撃を逃れるため(免疫逃避機構)の重要な因子と考えられています。よって多くのがん腫において、腫瘍内浸潤制御性T細胞の存在は予後不良因子として報告されていますが、大腸がんにおいては予後良好因子であるという他のがん腫とは相反するような報告もなされており、大腸がんに対する制御性T細胞の免疫応答は明らかにされてきませんでした。
近年、腸管に存在する腸内細菌叢が免疫応答を調節する上で重要な働きをしていることが明らかになり、ある種の細菌により制御性T細胞が誘導されることが示されています。大腸がんと関連する細菌も報告されていますが、腸内細菌による免疫応答の変化がどのように大腸がんに影響を与えるかは明らかになっていませんでした。
坂口教授の研究チームは、これまで、FOXP3陽性細胞の中にも、抑制能を持たない細胞群が存在することを報告してきました。このような細胞群は制御性T細胞を除去するようながん免疫療法を検討していく上で、極めて重要な問題でした。
今回の研究で、ヒト大腸がんに浸潤するリンパ球をより詳細に解析することで、本来の制御性T細胞と抑制能を持たないFOXP3陽性細胞の役割を解明するとともに、腸内細菌がそれらの細胞を誘導する上で与える影響を明らかにしました。
研究の手法と成果
研究グループは、ヒト大腸がんから生きたまま抽出した腫瘍浸潤リンパ球 において、どのようなFOXP3陽性細胞群が存在するかを検討しました。CD4陽性細胞(ヘルパーT細胞)中のFOXP3陽性細胞を分析したところ、大腸がん35例中、約半数の大腸がん検体において多数のFOXP3弱発現細胞 (Fr-III; FOXP3 lo CD45RA - CD4 + )が浸潤しており (図1) 、またそれらの細胞群はほとんど免疫抑制能を示さないことが明らかになりました (図2) 。FOXP3弱発現細胞が少ない大腸がんをType-A、多く存在する大腸がんをType-Bと規定し、この2群間の腫瘍形成および増殖に関わる因子を網羅的に比較検討することにより、腫瘍内浸潤リンパ球が異なる原因を解析しました。Type-A、Type-B大腸がんの各2例から抽出したmRNAを用い、網羅的遺伝子発現解析を実施したところ、Type-B大腸がんで免疫反応と炎症反応関連遺伝子が亢進していることが示されました (図3) 。これらのデータを元に、より詳細に遺伝子発現を解析したところ、Type-B 大腸がんでは IL12A と TGFB1 mRNAが高発現していることが分かりました。
以上より腫瘍内 IL12A 、 TGFB1 mRNA発現を基準として大腸がんTypeを予測出来ることが明らかとなったため、別の大腸がん症例群109例について、この分類法を用いて各腫瘍Typeに分類し、各群においてFOXP3 mRNA発現が予後へどう影響するかを検討しました。Type-A大腸がん (FOXP3 + T細胞の大部分は制御性T細胞、 図1 )においては、FOXP3高発現が予後不良因子であったのに対し、Type-B大腸がん (FOXP3陽性細胞の半数以上は免疫抑制能を示さない、 図1 , 2 )においては、むしろ FOXP3 高発現が予後良好な傾向を示しました (図4) 。
最後に、免疫学的に異なる2つのタイプの大腸がんの内、特にType-Bで炎症反応を引き起こす原因を究明するために、大腸がんに付着する腸内細菌の評価を行いました。その結果、Type-B大腸がんにおいては、腸内細菌、とりわけFusobacterium spp.の浸潤が認められるのに対し、Type-A大腸がんでは腸内細菌の腫瘍内への浸潤が認められませんでした (図5) 。
以上より、大腸がんは、浸潤するリンパ球において2種類に分類され、とくにFOXP3陽性細胞の中で抑制機能を持たないFOXP3を弱発現する細胞群の存在が、重要な因子となっていることが明らかになりました。これは大腸がんの発がん過程の違いによることが推測されます。また、大腸がんに付着する腸内細菌が腫瘍に浸潤することで腫瘍内炎症反応を惹起し、FOXP3を弱発現する活性化T細胞を誘導し、腫瘍免疫を亢進することが示されました。逆にFOXP3を強発現する制御性T細胞は他のがん腫と同様に、抗腫瘍免疫応答の抑制に働くことが解明されました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、大腸がん腫瘍内におけるFOXP3陽性細胞の正確な評価が可能になりました。がん免疫の最前線である腫瘍内において、これらの細胞群を明確に同定できることは、制御性T細胞を標的としたがん免疫療法を開発する上で、標的がん腫を正確に抽出するための非常に有用なマーカーとなりうると考えられます。特に大腸がんでは未だ一部の腫瘍でしか、がん免疫療法の効果が認められないことが分かっており、本研究成果により新たな標的患者群が明らかになるとともに、制御性T細胞を標的としたがん免疫療法の可能性が示唆されました。
加えて、腸内細菌が腫瘍内炎症を介して腫瘍免疫を亢進する可能性があることが示され、腸内細菌をコントロールすることが大腸がん治療にも応用できる可能性が期待されます。
特記事項
本研究成果は4月26日(火)午前0時(日本時間)に「Nature Medicine」に掲載されました。
【著者】Takuro Saito, Hiroyoshi Nishikawa, Hisashi Wada, Yuji Nagano, Daisuke Sugiyama, Koji Atarashi, Yuka Maeda, Masahide Hamaguchi, Naganari Ohkura, Eiichi Sato, Hirotsugu Nagase, Junichi Nishimura, Hirofumi Yamamoto, Shuji Takiguchi, Takeshi Tanoue, Wataru Suda, Hidetoshi Morita, Masahira Hattori, Kenya Honda, Masaki Mori, Yuichiro Doki and Shimon Sakaguchi
【論文タイトル】“Two FOXP3+CD4+ T-cell subpopulations distinctly control the prognosis of colorectal cancers”
【論文掲載誌】 Nature Medicine 2016
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」研究開発領域(研究開発総括:宮坂昌之)における研究開発課題「制御性T細胞による慢性炎症制御技術の開発」(研究代表者:坂口志文)の一環で行われました。 また、大阪大学免疫学フロンティア研究センター(IFReC)は、日本が科学技術の力で世界をリードしていくため「目に見える世界的研究拠点」の形成を目指す文部科学省の「世界トップレベル研究拠点プログラム(WPI) 」に採択されています。
参考図

図1 大腸がんにはFOXP3弱発現の細胞群(Fr-III)が多数浸潤する腫瘍が存在する。
大腸がん患者より集積した末梢血、正常大腸粘膜、腫瘍からのリンパ球を抽出し、CD4陽性細胞中のFOXP3の発現を評価した。約半数の大腸がん (Type-B大腸がん)においては、FOXP3を弱発現する細胞群 (Fr-III; FOXP3 lo CD45RA - )が多数認められた。特徴的なFlow cytometry染色。
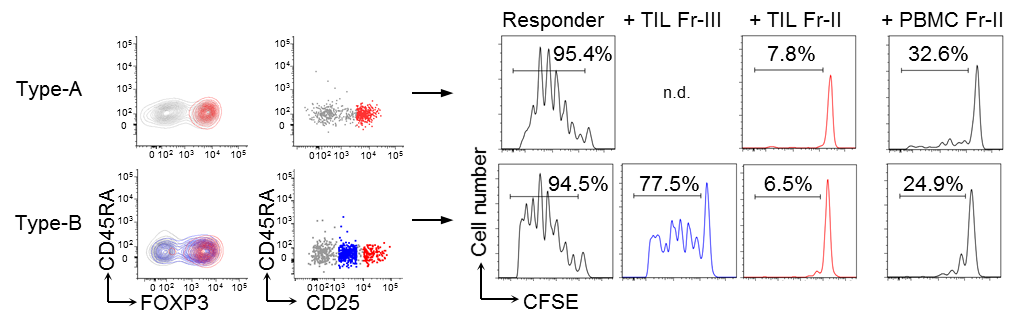
図2 大腸がん腫瘍浸潤リンパ球中のFOXP3弱発現CD4陽性細胞は抑制能を持たない。
大腸がん患者のPBMCから分離したCD4陽性細胞 (Responder)をCFSEラベルし、同一患者の腫瘍浸潤リンパ球より分離したFOXP3陽性細胞と混合し、Responderの細胞増殖を評価することにより、FOXP3陽性細胞の抑制能を解析した。FOXP3 hi 細胞 (Fr-II)が強い増殖抑制能を示したのに対し、FOXP3 lo 細胞 (Fr-III)はほとんど抑制能を示さなかった。
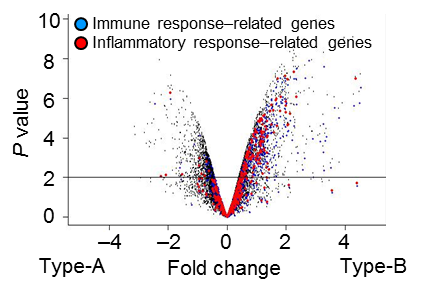
図3 Type-B 大腸がんにおいては、免疫反応と炎症反応関連遺伝子の発現が亢進している。
Type-A, Type-B大腸がんの各2サンプルより抽出したmRNAをmicroarrayにより比較評価した。免疫反応(青)と炎症反応(赤)に関連する遺伝子群がType-B腫瘍において発現亢進していることが明らかになった。
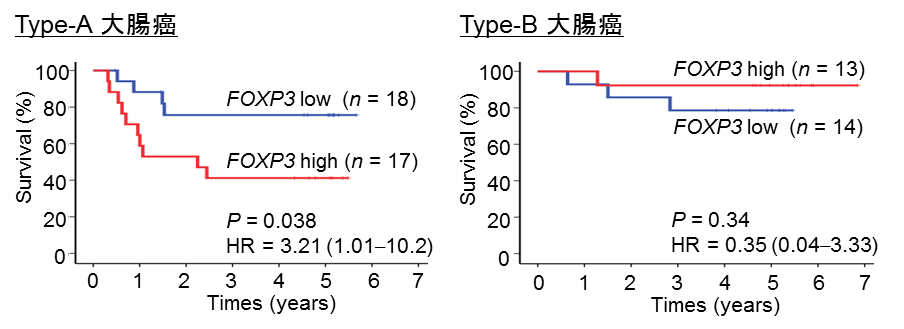
図4 Type-A大腸がんにおいては、FOXP3高発現が予後不良因子である。
IL12A, TGFB1 mRNAを用いてType-A, Type-B大腸がんを分類し、各群において FOXP3 mRNA発現が大腸がんの予後にどう影響するかを評価した。Type-A大腸がんにおいては、 FOXP3 高発現が予後不良因子であったのに対し、Type-B大腸がんにおいては、むしろ FOXP3 高発現が予後良好な傾向を持っていた。

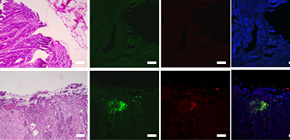
図5 Type-B大腸がんにおいては、腸内細菌の腫瘍への浸潤が観察される。
大腸がん腫瘍に浸潤する細菌を、FISH (Fluorescence in situ hybridization)で評価した。EUB338 (細菌)とFUSO (Fusobacterium spp.)を評価したところ、Type-A大腸がんでは細菌の浸潤が全く確認されないのに対し、Type-B大腸がんにおいては、細菌、Fusobacterium spp.の浸潤が確認された。
参考URL
大阪大学免疫学フロンティア研究センター 実験免疫学
http://exp.immunol.ifrec.osaka-u.ac.jp/
論文掲載先(Nature Medicine)
http://www.nature.com/nm/journal/vaop/ncurrent/full/nm.4086.html
用語説明
- 制御性T細胞
制御性T細胞 (Regulatory T cell :Treg):
FOXP3をマスター遺伝子とする、様々な免疫応答を負に制御するT細胞。とくに腫瘍を攻撃する免疫細胞を抑制することで、抗腫瘍免疫に働くと考えられています。細胞表面にCD4というタンパク質が発現しているCD4陽性細胞(ヘルパーT細胞)の一種です。
- FOXP3
FOXP3 (Forkhead Box P3):
制御性T細胞のマスター遺伝子。この転写因子の発現により、制御性T細胞の抑制能が規定されます。
- 弱発現
本来は制御性T細胞の抑制に重要な転写因子FOXP3の発現が弱い状態です。結果として、免疫抑制(負の制御)が弱まります。
- サイトカイン
細胞から分泌されるタンパク質で、細胞間の情報伝達を担うものを指します。特に免疫細胞においては、炎症を引き起こすサイトカインが重要と考えられ、IL-12やTGF-βが代表的です。
- 浸潤
本来その組織固有のものでない細胞が、組織の中に現れることをいいます。この場合は大腸がんの細胞にT細胞や腸内細菌が入り込むことを指します。
- PD-1
PD-1 (Programmed Death 1):
T細胞上に発現する免疫抑制性分子。抗原提示細胞もしくは腫瘍細胞上のPD-L1抗原と結合することにより、過剰な免疫応答を抑制しています。
- CTLA-4
CTLA-4 (Cyto Cytotoxic T-lymphocyte-associated antigen-4):
T細胞上に発現する免疫抑制性分子。免疫共刺激分子であるCD28と競合することにより過剰な免疫応答を抑制しています。
- 免疫チェックポイント分子阻害薬
PD1やCTLA-4などは免疫細胞を非活性化させるシグナルを送る免疫チェックポイント分子と呼ばれます。これらに対する抗体が免疫チェックポイント分子阻害薬であり、免疫細胞を活性化させる働きを持ちます。
- 腫瘍浸潤リンパ球
腫瘍に浸潤するリンパ球群で、腫瘍を攻撃する因子と防御する因子の両方を含みます。
