
炎症の強さの調整機構を発見
アレルギー疾患など炎症性疾患の病因解明・治療薬開発に期待
リリース概要
大阪大学 免疫学フロンティア研究センター/微生物病研究所の王静研究員と荒瀬尚教授らの研究グループは、炎症の強さを調節する分子PILRαを発見しました。
本研究成果の意義、社会に与える影響
炎症は、感染等に対する重要な生体防御応答の一つであり、局所への好中球 の浸潤等を伴います。しかし、過剰な炎症は、臓器障害を引き起こしたり、自己免疫疾患やアレルギー疾患の発症原因の一つになったりします。従って、どのように過剰な炎症が起こらないように調節されているかを解明することは、様々な炎症性疾患 の病因解明や治療法の開発のために大変重要です。ところが、炎症の調節機構、特に、好中球の局所への浸潤がどのように調節されているかは、まだ十分に明らかにされておりません。
本研究グループは、好中球の細胞表面にPILRαという膜蛋白分子が強発現していることを発見しました。そこで、PILRα欠損マウスを作製することによって好中球の発現するPILRαの機能を解析した結果、炎症の際にPILRαがインテグリン という接着分子の活性化を抑制することにより、局所への好中球の浸潤を抑えて過剰な炎症が起こらないようにしていることを世界で初めて突き止めました。
本研究成果は、様々な炎症性疾患の病因解明に貢献するばかりでなく、炎症性疾患の治療薬開発に役立つことが大いに期待されます。
特記事項
本研究成果は、米国の科学雑誌『Nature Immunology』(11月11日付, 日本時間: 11月12日午前3時)にオンライン掲載されます。本研究は、独立行政法人科学技術振興機構(JST)の戦略的創造研究推進事業 チーム型研究(CREST)研究領域:「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」(研究総括:菅村 和夫 宮城県立病院機構 理事長)研究課題名:「ペア型レセプターを標的とした免疫・感染制御技術の開発」研究代表者:荒瀬 尚(大阪大学 微生物病研究所 教授)の一環として行いました。
研究の詳細な説明
1. 背景
炎症は感染等によって引き起こされる生体防御反応の一つです。感染等が起こると、局所へ好中球等の白血球が集まり、病原体を排除しようとする生体応答が炎症であり、生体防御において非常に重要な免疫応答です。しかし、過剰な炎症が引き起こされてしまうと、臓器障害が引き起こされたり、様々な自己免疫疾患やアレルギー疾患が引き起こされたりします。従って、どのように過剰な炎症応答が起こらないように制御されているかを解明することは、それらの疾患の原因の解明や治療法を開発する上で非常に重要です。しかし、炎症を制御する分子機構、特に好中球の局所への浸潤を抑制する分子機構に関しては、いままで十分にわかっておりませんでした。そこで、本研究はどのような分子機構によって過剰な炎症が起こらないように調節されているかについて、抑制化と活性化の両方のレセプターからなるペア型レセプター に焦点をあてて研究を進めてきました。
2. 研究の手法と成果
本研究グループは、炎症応答で中心的な役割を担っているヒトやマウスの好中球の細胞表面分子を調べたところ、ペア型レセプターの一つで抑制化の働きをもつPILRαが強発現していることを突き止めました(図1)。そこで、好中球に発現しているPILRαの機能を明らかにするためにPILRαを欠損したマウスを作成してPILRαの機能解析を行いました。その結果、PILRα欠損マウスでは、野生型マウスと比べて、細菌感染後によって引き起こされる過剰な炎症応答であるエンドトキシンショック に対する感受性が高く、容易に死亡することを発見しました(図2)。さらに、PILRα欠損マウスでは、肝臓等の組織においても、好中球の浸潤が亢進し、組織破壊が認められました(図3)。これらのことから、PILRαが過剰な炎症が起こらないように炎症の強さを調節していることが明らかになりました。
次に、PILRαがどのように炎症を調節しているのかを解析したところ、PILRαは、同一の好中球上に発現している分子とシアル酸依存性に結合することによって、抑制化シグナルを好中球に伝達していることを明らかにしました(図4)。さらに、PILRαによって伝達された抑制化シグナルは、好中球の組織への浸潤に重要な機能を担っているインテグリンの機能を阻害することを解明しました(図5)。
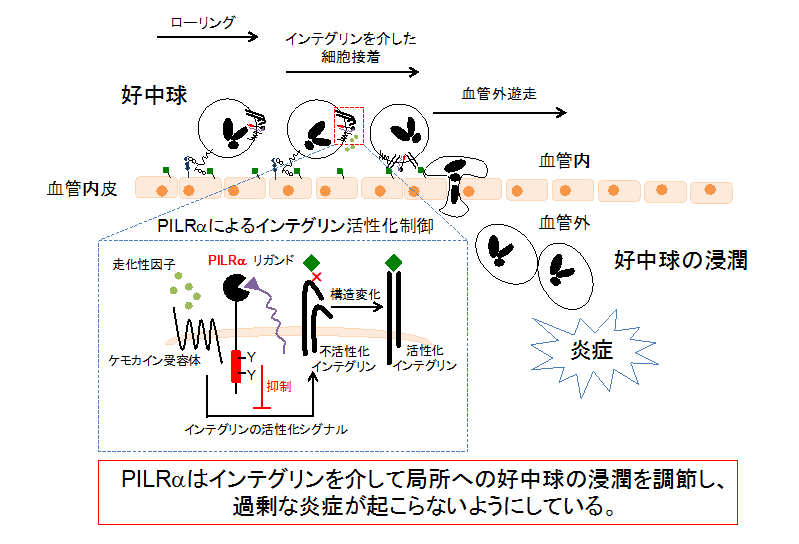
以上のように、本研究では好中球上のPILRαがインテグリンを介して好中球の浸潤を抑制することによって、過度な炎症が起こらないように調節していることを、世界に先駆けて発見しました(図6)。
3. 今後の期待
炎症は感染等に対する生体防御に重要な役割を担っている一方、過剰な炎症は、エンドトキシンショックの他、自己免疫疾患やアレルギー疾患等の一因になっております。従って、PILRαの機能を活性化する薬剤等を開発することによって、過剰な炎症を抑えることができるようになる一方、逆にPILRαの機能を阻害する薬剤等を開発することによって、効果的な免疫応答を誘導でき、ワクチン開発等にも役立つと思われます。以上のように、本研究成果は、炎症制御のための新たな分子標的として大いに期待できると思われます。
参考図
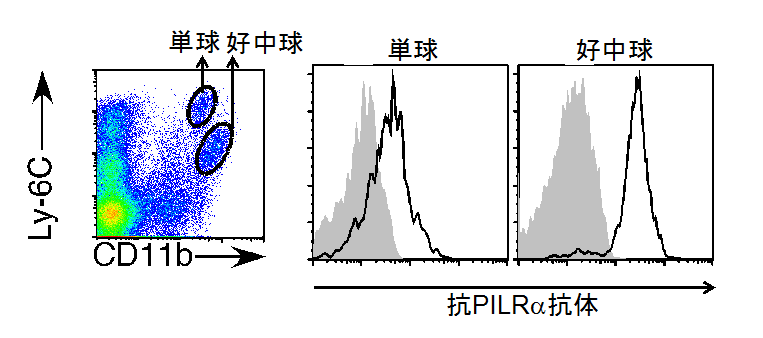
図1 PILRαは主に好中球で発現する
マウスの脾臓の単球および好中球を抗PILRα抗体で染色した(実線)。灰色はコントロール染色を示す。
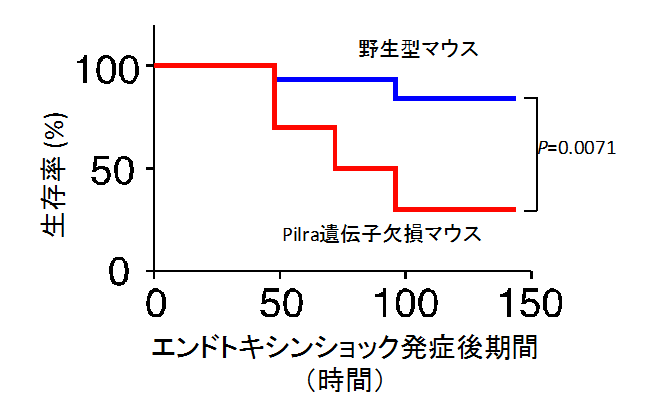
図2 PILRα欠損マウスはエンドトキシンショックに高い感受性を示す
野生型およびPILRα欠損マウスにリポ多糖(LPS)を投与し、エンドトキシンショック後の生存率を観察した。その結果、PILRα欠損マウスはエンドトキシンショックに感受性が高いことが明らかになった。
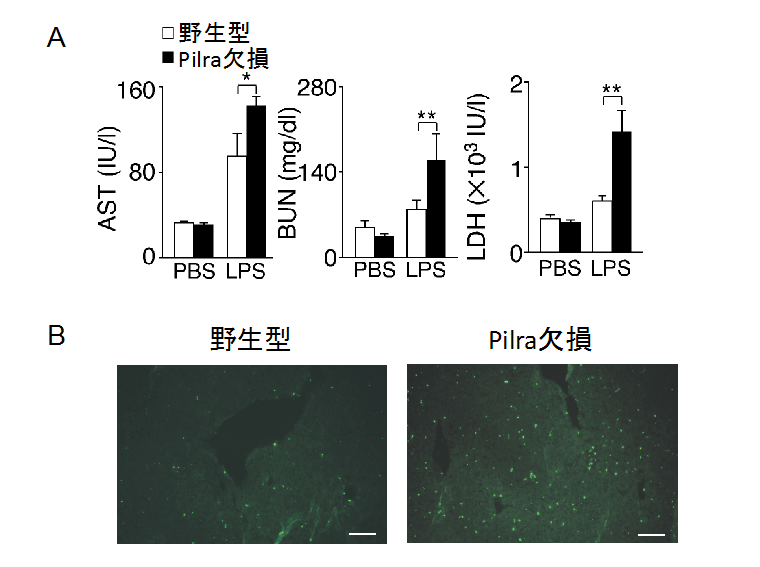
図3 PILRα欠損マウスではエンドトキシンショックにより重度の臓器障害や過剰な好中球浸潤が認められる
(A) エンドトキシンショックを起こしたPILRα欠損マウスでは、臓器障害を示すAST、BUN、LDHの顕著な増加が認められた。
(B) エンドトキシンショックによってPILRα欠損マウスの肝臓への顕著な「好中球」(緑)の浸潤が認められた。
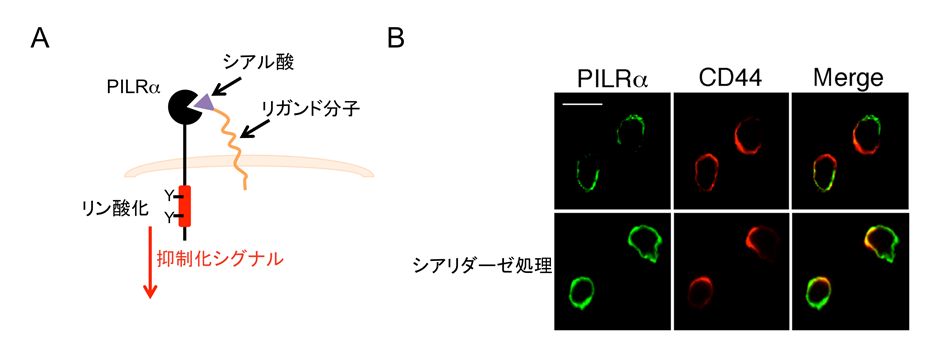
図4 PILRαは内因性リガンドとの結合による抑制化シグナルを伝える
(A) PILRαは同じ好中球の細胞表面に発現している分子とシアル酸依存性に結合する。
(B) 活性化された好中球の細胞表面でPILRαは集合体を形成し、抑制化シグナルを伝達する。一方、シアリダーゼの処理によって細胞表面のシアル酸を除去するとPILRαの集合体形成は認められない。
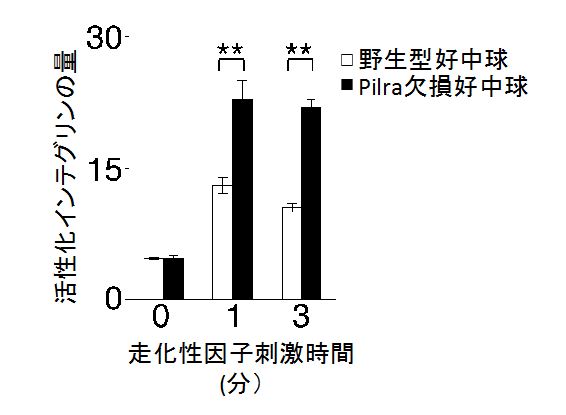
図5 PILRαはインテグリンの活性化を抑制する
インテグリンの走化性因子の刺激による活性化は、PILRαを欠損した好中球では顕著に上昇した。

図6 PILRαによる炎症応答の制御機構
血管中を流れている好中球が炎症局所に動員されるためには、好中球がインテグリン分子を介して血管内皮細胞に接着することが必要である。PILRαはインテグリンの活性化を抑制することによって、好中球の局所への浸潤を調整していることが明らかになった。
参考URL
用語説明
- 好中球
白血球のなかの約70%は好中球で、普段血管内で流れているが、体内に細菌や異物の侵入を感知し、血管壁をすり抜け、侵入物のいる場所へ移動する。生体防御において非常に重要な機能を担っている細胞である。
- 炎症性疾患
炎症を起こす疾患の総称。急性炎症を起すものとしては感染によって引き起こされるエンドトキシン等がある。一方、慢性炎症を引き起こすものとして種々のアレルギー疾患や自己免疫疾患などが知られているが、発症原因はほとんど不明である。
- インテグリン
細胞表面タンパク質のひとつで、細胞接着に重要な機能を担う分子である。インテグリンの結合能は、構造変化によってダイナミックに調節をうける。
- ペア型レセプター
活性化と抑制化レセプターから成る一連のレセプター群であり、免疫細胞に広く発現し、自己に対する免疫応答の制御や感染防御に重要な機能を担っている。
- エンドトキシンショック
グラム陰性菌感染の際に、壊れた細菌から放出された内毒素(エンドトキシン)に対する急性炎症反応によって引き起こされたショック状態をさす。
