パーキンソン病の病態をモデルマウスでより正確に再現
発症機序の解明・治療開発に寄与するツールとして期待
研究成果のポイント
・パーキンソン病で見られる、レビー小体の形成、黒質ドパミン神経の脱落など病理学的な特徴を再現したマウスの作製に成功した
・パーキンソン病の病態にαシヌクレインの凝集体であるフィブリルの立体構造が大きく影響することを確認
・パーキンソン病の病態解明や新たな治療法の開発への応用に期待
概要
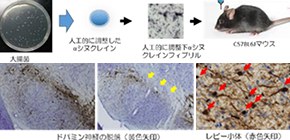
大阪大学大学院医学系研究科の馬場孝輔特任講師(常勤)(神経内科学望月教授)らの研究グループは、人工的に合成したαシヌクレイン凝集体を直接マウス脳に接種 (図1a) することで、パーキンソン病 の病理学的特徴であるレビー小体 の形成と、それに続く進行性のドパミン神経の脱落を再現し、よりヒトのパーキンソン病病態に近い優れたモデルの作製に成功しました (図1b) 。
これまで、パーキンソン病の病理学的な特徴を反映した適切な動物モデルが存在しないことから、治療法の開発が遅れており、病気の進行を抑制する根本的治療は存在せず、ほとんどが対症療法にとどまっています。パーキンソン病では、脳内でレビー小体の形成が見られますが、そのレビー小体の主要構成成分がαシヌクレイン です。
今回、馬場特任講師らの研究グループは、重症の遺伝性パーキンソン病患者で確認されているG51D遺伝子変異を持つ、G51D変異αシヌクレインが重合した凝集体(フィブリル)を人工的に作製しました。このG51D凝集体は、通常の(変異のない)ヒトαシヌクレインと比較して、病的タンパク質の構造的特徴であるβシート構造を約2倍もつことが分かりました。
このG51D変異αシヌクレイン凝集体をマウスの片側黒質へ接種したところ、広範な脳領域にレビー小体の形成を確認し、またそれが時間と共に広がっていることが分かりました。さらに、黒質ドパミン神経の脱落も認められました。
本研究成果は、パーキンソン病の病態にαシヌクレインの凝集体の立体構造が大きく影響することを示した重要な成果であり、αシヌクレインを原因とする他の神経疾患(レビー小体型認知症や多系統萎縮症)の病態解明にも寄与することが期待されます。また、パーキンソン病の新たな進行抑制を可能とする病態修飾療法の開発、発症機序の解明に寄与するツールとしてパーキンソン病研究の発展に寄与すると考えられます。
本研究成果は、2019年10月24日(木)午前7時(日本時間)に米国科学誌「Movement Disorders」(オンライン)に掲載されました。
図1 研究概要図
研究の背景
パーキンソン病は、アルツハイマー病に次いで2番目に多い進行性の神経変性疾患で、臨床的には運動障害、病理学的には進行性の黒質ドパミン神経の脱落、レビー小体の形成を特徴としています。現在、多くの抗パーキンソン病薬が承認されていますが、そのほとんどはドパミン補充による対症療法で進行を抑制する根本的な治療は存在しません。これまでのパーキンソン病研究では、神経毒等を用いた薬剤性パーキンソン病モデルが多用されてきました。これら薬剤モデルは、黒質ドパミン神経の脱落とそれに伴うドパミン欠乏は再現できますが、作用機序がミトコンドリア障害や酸化ストレスであり、αシヌクレインの蓄積によるレビー小体の形成は認めず、それに続く緩徐進行性のドパミン神経の脱落が表現されません。パーキンソン病の病理学的特徴を反映した適切な動物モデルが存在していないことが、病態修飾療法の開発に関しての最大の障壁となっていました。
パーキンソン病の病理学的特徴は、黒質ドパミン神経の変性とレビー小体の形成です。そのレビー小体の主要構成成分がαシヌクレインです。αシヌクレインが神経細胞内でミスフォールドし、重合して凝集体を形成、細胞毒性を発揮、さらに細胞間を伝搬することで病態が進行するという“プリオン仮説”が現在のパーキンソン病の病態仮説の主流となっています。近年、αシヌクレインのプリオン仮説に基づくモデル動物の作製、すなわちin vitro(イン・ヴィトロ;試験管内)で調整したαシヌクレイン凝集体をマウス脳へ直接接種する方法論による研究が広く行われています。しかし、これまで、通常の(野生型)αシヌクレイン凝集体を用いた研究では、αシヌクレインの蓄積によるレビー小体の形成と緩徐進行性の黒質ドパミン神経の脱落の両方を完全に再現した結果はありませんでした。
そこで、馬場特任講師らの研究グループは、野生型αシヌクレインではなく、家族性パーキンソン病患者で確認されているαシヌクレイン変異の中で最重症であるG51D遺伝子の変異に着目して、G51D変異αシヌクレイン凝集体を用いて、マウス脳への直接接種を行い、その病理学的解析を行いました。
本研究の成果
研究グループは、G51D変異αシヌクレインが重合した凝集体を人工的に調整し、タンパク質の構造解析を行ったところ、変異のない(野生型)αシヌクレインと比較して、βシート構造含有率が約2倍であることが分かりました。βシート構造は、異常プリオンタンパク質等の病的タンパク質の構造的特徴の一つです。このG51D変異αシヌクレイン凝集体をマウスの片側黒質へ接種し、経時的に評価した結果、野生型αシヌクレイン凝集体と比べて、広範な脳領域にレビー小体の形成を確認しました。さらに接種後12週目から黒質ドパミン神経の脱落が始まり、24週では約70%の脱落を認めました。
この結果は、凝集体の立体構造の違いが病理学的違いを生み出すことを示す重要な知見であると言えます。また、本マウスは、緩徐進行性のレビー病理、黒質ドパミン神経の脱落を再現しており、よりヒトのパーキンソン病病態に近い優れたモデルと考えられます。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、異常タンパク質凝集体の立体構造がパーキンソン病をはじめとする神経変性疾患の病態に大きく関与することを示した重要な成果が得られました。本成果により、同じαシヌクレインを原因とするレビー小体型認知症や多系統萎縮症の病態解明に寄与することが期待されます。
また、今回作製したマウスは緩徐進行性のレビー病理、黒質ドパミン神経の脱落を再現しており、ヒトのパーキンソン病病態に近く、新たな進行抑制を可能とする病態修飾療法の開発、パーキンソン病の発症機序の解明に寄与するツールとしてパーキンソン病研究の発展に寄与することが期待されます。さらに遺伝子改変を必要としないため、幅広い応用展開が可能です。
特記事項
本研究成果は、2019年10月24日(木)午前7時(日本時間)に米国科学誌「Movement Disorders」(オンライン)に掲載されました。
【タイトル】“Structurally distinct α-synuclein fibrils induce robust Parkinsonian pathology.”
【著者名】Hideki Hayakawa 1 Rie Nakatani 1 Kensuke Ikenaka 1 Cesar Aguirre 2 Chi-Jing Choong 1 Hiroshi Tsuda 1 Seiichi Nagano 1 Masato Koike 4 Takeshi Ikeuchi 5 Masato Hasegawa 6 Stella M. Papa 7 Yoshitaka Nagai 1,3 Hideki Mochizuki *1 Kousuke Baba *1 . (*責任著者)
【所属】
1.大阪大学 大学院医学系研究科 神経内科学
2.大阪大学 蛋白質研究所
3.大阪大学 大学院医学系研究科 神経難病認知症探索治療学
4.順天堂大学 大学院医学研究科 神経機能構造学
5.新潟大学脳研究所 生命科学リソース研究センター バイオリソース部門 遺伝子機能解析学分野
6.東京都医学総合研究所 病態細胞生物研究室
7.米国 エモリー大学 医学部 Department of Neurology
本研究成果に関して、特許を出願し、特許を取得しています(特願 2018-063640 2018.3.29)
本研究は、日本学術振興会(JSPS)科学研究費助成事業、文部科学省(MEXT)科学研究費助成事業、日本医療研究開発機構(AMED)革新的技術による脳機能ネットワークの全容解明プロジェクトの一環として行われました。
参考URL
大阪大学 大学院医学系研究科 神経内科学HP
http://www.med.osaka-u.ac.jp/pub/neurol/myweb6/Top.html
用語説明
- パーキンソン病
振戦(ふるえ)、動作緩慢、筋強剛(筋固縮)、姿勢保持障害(転びやすいこと)を主な運動症状とする進行性の神経変性疾患であり、発症は50~65歳に多く、60歳以上における有病率は100人に約1人とされ、決して稀な疾患ではない。近年、便秘、嗅覚障害、レム睡眠行動異常といった全身性の非運動症状も呈することがわかっている。
- レビー小体
パーキンソン病の患者に見られる特徴的なタンパク質凝集体のことであり、その主成分はαシヌクレインというタンパク質であることがわかっており、人工的に作成したαシヌクレインの凝集体が脳内を伝播することが動物実験で確かめられている。また、これまでの研究から、病状の進行とともにレビー小体が増殖していくことが示唆されている。
- αシヌクレイン
神経細胞内に存在するタンパク質で、その生理的機能はよくわかっていない。パーキンソン病の原因タンパク質の一つである。αシヌクレインが何らかの原因にて異常構造をとりそれらがさらに重合し凝集体が形成されることで細胞内に蓄積していき細胞毒性を発揮すると考えられている。
