細菌の前進・後退を決めるタンパク質の構造を解明!
方向制御の人工ナノマシンの設計が可能に
研究のポイント
・魚の表面に付着している細菌の一種である海洋性ビブリオ菌が持つべん毛モーターの回転方向制御について、クラッチの役割をするタンパク質(FliG)中のどのアミノ酸残基が重要であるかを特定した。
・特定したアミノ酸残基周囲の構造特性が、回転方向決定に支配的な役割を果たすことを示した。
・外界の環境応答によるべん毛モーターの回転方向変換制御には、FliGおよびFliMタンパク質の精密な相互作用が必要不可欠であることが判明した。
研究の概要
名古屋大学大学院理学研究科の本間道夫教授、錦野達郎博士後期課程2年、大阪大学蛋白質研究所の宮ノ入洋平准教授、長浜バイオ大学バイオサイエンス学部の白井剛教授および土方敦司特任講師らの共同研究グループは、細菌が持つ運動器官であるべん毛 モーターを構成するタンパク質の一つFliG分子の構造動態を、核磁気共鳴法 および分子動力学計算法 を用いることで解明しました。FliG分子は、車で例えるならクラッチを構成する部品のような役割をします。べん毛モーターは時計回りと反時計回りの両方向に回転し、回転方向を切り替える際にFliGの構造変化が生じると考えられています。本研究により、時計回り(CW)のときと反時計回り(CCW)のときとではFliGの構造が異なることが示され、FliGが細菌の前進と後退を決定するために重要な役割を担っていることが明らかになりました。
この知見をもとに、生物特有の回転方向制御機構が解き明かされれば、自在に分子モーターを制御する人工的なナノマシンを設計することができるようになり、医療や人工生命設計など、様々な分野に応用できることが期待されます。
本研究成果は、英国科学誌「Scientific Reports」において、2018年12月12日午前10時(英国時間)にオンライン公開されました。
研究の背景
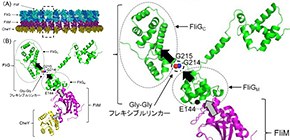
細菌は、"べん毛 "という繊維状の運動器官を使って水中を泳ぐことができます。べん毛は螺旋形をしており、回転することで推進力を生み出すスクリューとして働きます。べん毛の根元には細胞膜と細胞壁を貫通した回転モーターがあり、"べん毛モーター"と呼ばれています。べん毛モーターは、直径およそ45ナノメートルという極めて小さなモーターですが、F1マシンのエンジンの回転数に匹敵する20,000rpmという超高速で時計回り及び反時計回りの両方向に回転することができます。さらに、トップスピードから瞬時に回転方向を切り替えることも可能で、それでいて、ほぼ100%に近いエネルギー変換効率を持つという極めて優れたモーターです。この高性能モーターの機能は、20種類ほどのタンパク質によって達成されます。べん毛モーターの駆動部は"回転子"と"固定子"という二つの部分から構成されます。べん毛モーターを動かすエネルギー源は、細菌の細胞外から細胞内に流れ込む水素イオンやナトリウムイオンなどのイオン流で、イオンが固定子の中を通って流れ、その力を回転子に伝えることでモーターの回転力へと変換されます。モーターの回転方向は走化性シグナルと呼ばれる細胞周囲の環境を検知して、環境変化をモーターに伝達する機構によって制御されています (図1) 。回転子を構成するタンパク質のなかで、FliG,FliMおよびFliNは互いに相互作用することで、大きなリング状の構造を形成します。このリング構造が、回転力の発生および回転方向を高速で切り替えるスイッチング機構を制御しています。FliGは、固定子およびFliMと相互作用することが知られており、べん毛モーターの回転運動において主要な役割を担っていると考えられています (図2A) 。
FliGは、3つの領域(N末端ドメイン:FliGN、中間ドメイン:FliGM、C末端ドメイン:FliGC)から構成されています。これまでの研究から、ドメイン間の相互作用や、C末端ドメインと固定子との相互作用が、回転方向の変換制御、回転力(トルク)発生に重要な役割を担っていることが示唆されてきましたが、詳細な分子機構、相互作用様式の解明には至っていませんでした。
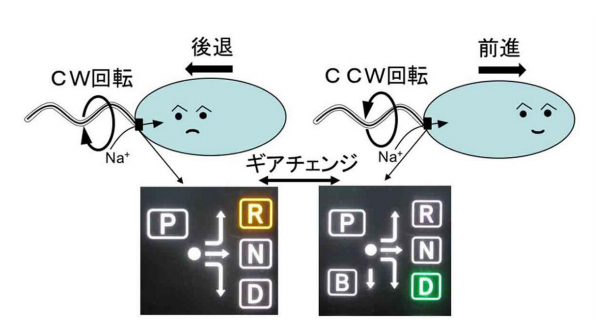
図1 ビブリオ菌の極べん毛回転と運動方向制御。
細胞表面から生えた繊維(べん毛)をスクリューのように回転させることで、泳ぐための推進力を生み出す。反時計回り(CCW)で回転すれば、前進、時計回り(CW)で回転すれば後退する。べん毛の根元には回転モーター(べん毛モーター)が存在し、回転子と固定子の相互作用によって回転力が作られる。べん毛の回転方向は膜上の受容体からCheY(走化性シグナルの因子)へシグナルが伝達され、CheYが回転子に結合することで、モーターの回転方向が変化する。
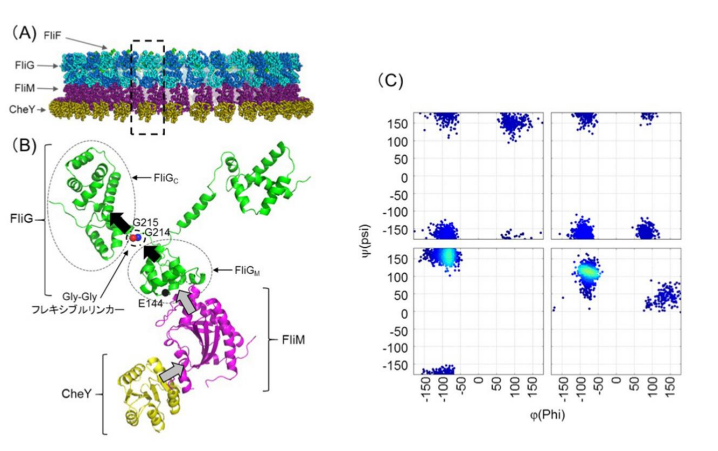
図2
(A)回転子部分の電子顕微鏡解析で得られた立体構造に、FliF(一部),FliG,FliM,CheYの結晶構造で解かれている部位が当てはめられた。(B)(A)の点線で囲まれている1セットのFliG,FliM,CheY分子を記載した。青色、赤色、および黒色のボールは、G214、G215、E144残基をそれぞれ示す。灰色の矢印は、FliMに対するCheYの結合がFliGMに対する影響を示す。黒色の矢印は、分子内FliGの構造変化を示す。本モデルにおいて、FliMへのCheY結合はFliGMの構造変化を誘発する。この変化は、Gly-Glyフレキシブルリンカーによって感知され、FliGCの構造変化を誘起する。これらの構造変化が、回転子のFliG全体に伝達されることで、回転方向の切り替え(ギアチェンジ)が生じる。(C)前進と後退時のGly-Glyフレキシブルリンカーのとりうる構造。野生型及びE144D変異は4点に青のプロットがみられた。回転方向制御が偏るG214S変異及びG215A変異ではプロットが2点に集約されることから取りうる構造が減ってしまったと考えられる。
研究の内容
本研究では、遺伝子組み換え技術により、海洋性ビブリオ菌Vibrio alginolyticusのモーターの回転方向制御に異常をきたすアミノ酸変異をFliGタンパク質に導入し、回転方向の変換制御機構の解明を目指しました。様々な変異体のうち、214番目のアミノ酸であるグリシン(G214)をセリンに置換した変異体(G214S)は、べん毛の回転方向が反時計回り(前進)に偏り、215番目のアミノ酸であるグリシン(G215)をアラニンに置換した変異体(G215A)は回転方向が時計回り(後退)に固定されました。これにより、たった一カ所の隣り合ったアミノ酸変異で、回転方向が固定されるという非常に面白い結果が得られました。また、144番目のアミノ酸であるグルタミン酸(E144)をアスパラギン酸に置換した変異体(E144D)は、細胞は前進・後退を繰り返しその場から進むことができなくなりました。この理由は、E144D変異体では、野生型と比較して回転方向の切り替え頻度が2倍以上高くなるためであることがわかりました。これら3つの変異がそれぞれFliGにどのような構造変化を生じさせているかを明らかにするために、FliGの部分構造(FliGMとFliGC領域のみ)を合成し、その特性を野生型と今回作った変異体とで比較しました (図2B) 。
核磁気共鳴法 および分子動力学法 を用いて解析したところ、G214S変異型FliGMCおよびG215A変異型FliGMCでは、野生型FliGMCと比較して、構造の柔軟性が制限されていることが明らかとなりました (図2C) 。FliGMとFliGCの間には、グリシン残基が並んだ(Gly-Gly)ちょうつがい(フレキシブルリンカー)のような役割を果たす領域があり、変異が導入されているG214およびG215はまさにこのちょうつがいの位置に存在します。変異体の解析から、べん毛モーターの回転方向決定には、この蝶番の部分の構造の柔軟性が決定的な役割を果たしていることが示唆されました。一方で、E144D変異型FliGMCは野生型FliGMCと類似の構造特性を持っていることがわかりました。
さらに、外部環境からのシグナルの応答性能について野生型と変異体で比較したところ、E144D変異体には異常がみられることもわかりました。E144はFliMとの結合界面に存在しています。E144D変異体では、ちょうつがい部分の構造特性に直接的な影響はないものの、FliMからの走化性シグナルが正しく伝わらないために、回転方向切り替えが過度に生じてしまうことが示唆されました。
本研究によって、FliGが内在的に持つダイナミックな構造特性およびFliMとの綿密な相互作用が、べん毛モーターの回転方向の決定と切り替えを瞬時かつ精密に実行可能にするために必要不可欠であることが明らかとなりました。
成果の意義
細菌の運動器官であるべん毛モーターは、細菌が自身の細胞の中で様々なタンパク質の部品を自発的に組み立てて作リ出す微小機器(生体ナノマシン)として、医療や機械工学などの様々な分野から注目を集めています。べん毛モーターは直径わずか50ナノメートル(髪の毛の太さのおよそ1000分の1)以下という小ささで、秒速200~1000回転以上という速さで回転します。このようなナノマシンは、現在の人類の科学技術でも人工的に作ることはできません。その理由の一つは、モーター全体の詳細な立体構造がわかっていないことです。本研究から、この生体ナノマシンの回転方向を制御する部品の構造動態が明らかとなりました。今回見つかった特徴的なダイナミクスが、高いエネルギー変換効率でモーターの回転方向を瞬時かつ精確に変換するためにも重要であることが予想されます。この知見をもとに、生物特有の回転方向制御機構が解き明かされれば、自在に分子モーターを制御する人工的なナノマシンの設計が可能となり、医療や人工生命設計など様々な分野に応用できることが期待されます。
特記事項
本研究は、科研費新学術領域「運動マシナリー」、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業(BINDS))、大阪大学蛋白質研究所超高磁場NMR共同利用研究課題の支援を受けて行われました。また、本研究は名古屋大学、長浜バイオ大学、大阪大学が共同で行ったものです。
論文情報
掲載誌:Scientific reports
論文タイトル:" Rotational direction of flagellar motor from the conformation of FliGmiddle domain in marine Vibrio "
著者:Tatsuro Nishikino, Atsushi Hijikata * , Yohei Miyanoiri, Yasuhiro Onoue, SeijiKojima, Tsuyoshi Shirai, Michio Homma * ( * These authors contributedequally to this work as correspondence)
DOI:10.1038/s41598-018-35902-6
参考URL
大阪大学 蛋白質研究所 蛋白質解析先端研究室センター 先端計測研究室
http://www.protein.osaka-u.ac.jp/rcsfp/apc/nmr/index.html
用語説明
- べん毛
細菌の細胞表面から生えた螺旋状の運動器官。その根元には、細胞膜に埋め込まれた回転モーターが存在する。モーターは固定子と固定子から構成され、相互作用して回転力(トルク)を生み出す。
- 核磁気共鳴法
原子核の磁気的性質(核スピン)を観測する分光法。原子核の周りの電子の状態や原子の結合状態を知ることができるため、蛋白質の立体構造情報を知ることができる。結晶構造解析と異なり、溶液中の状態でも解析できるため、蛋白質の運動性や細胞内環境での構造情報を捉えることができる。
- 分子動力学計算法
多数の原子が集まってできたタンパク質などの集合体の構造や動きをコンピュータ計算によって研究する手法。分子を構成する各原子に働く力について、ニュートンの運動方程式から作られた特別な計算式を用いて数値的に解いていくことで、分子がどのように動いていくかをコンピュータ上でシミュレーション(類推)できる。
