DNAは、生きた細胞の中で不規則な塊を作っていた!
遺伝子情報や細胞関連疾患の理解につながる成果
概要
DNAは規則正しくらせん状に折り畳まれて細胞の核の中に収められていると、長い間考えられてきました。ところが近年、この規則正しい構造は存在せず、不規則に核のなかに収納されていることがわかってきました。しかしながら、実際の収納の様子を「生きた細胞」で捉えた決定的な証拠はありませんでした。
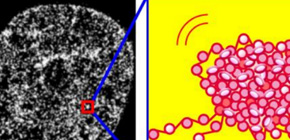
このたび情報・システム研究機構 国立遺伝学研究所・野崎慎研究員・前島一博教授らと大阪大学・永井健治教授、理化学研究所・岡田康志チームリーダーの共同グループは、光学顕微鏡の分解能を超える超解像蛍光顕微鏡 を構築することで、生きた細胞内におけるDNAの収納の様子を観察することに世界で初めて成功しました。その結果、DNAは不規則に折りたたまれ、「クロマチンドメイン」とよばれる小さな塊を形作っていることがわかりました (図1) 。このクロマチンドメインは細胞増殖、細胞分裂を通じて維持されていることから、遺伝情報の検索・読み出し・維持に重要な染色体ブロック(機能単位)として働くことが示唆されます。
本研究の結果によって、遺伝情報がどのように検索され、読み出されるのかについての理解がさらに進むとともに、DNAの折りたたみの変化で起きるさまざまな細胞の異常や関連疾患の理解につながることが期待されます。
図1 左は従来の生細胞の顕微鏡像(DNAを染色している)。中央は今回の研究で得られた超解像のクロマチン像。より細部の構造がはっきりと分かり、つぶつぶのクロマチンの塊(クロマチンドメイン)が観察された。(右)ヌクレオソーム(研究の背景参照)が塊を作ってドメインを形成すると考えられる。
成果掲載誌
本研究成果は、平成29年7月13日12時(米国東部時間)に米国科学雑誌Molecular Cellに掲載されました。
論文タイトル:Dynamic organization of chromatin domains revealed by super-resolution live-cell imaging(生細胞超解像イメージングによって明らかにされたダイナミックなクロマチンドメイン構造)
著者:Tadasu Nozaki, Ryosuke Imai, Mai Tanbo, Ryosuke Nagashima, Sachiko Tamura, Tomomi Tani, Yasumasa Joti,Masaru Tomita, Kayo Hibino, Masato T. Kanemaki, Kerstin S. Wendt, Yasushi Okada, Takeharu Nagai, and KazuhiroMaeshima(野崎慎、今井亮輔、端保舞、永島崚甫、田村佐知子、谷知己、城地保昌、冨田勝、日比野佳代、鐘巻将人、カースティンウェント、岡田康志、永井健治、前島一博)
研究の詳細
研究の背景
私たちの体を構成する一つ一つの細胞には、全長2メートルに及ぶゲノムDNAが収められています。このDNAは直径2ナノメートル のとても細い糸で、「ヒストン」という樽状のタンパク質に巻きつくことで、直径約11ナノメートルの「ヌクレオソーム」を作ります( 図2 上段)。今から40年以上前に提唱された説では、このヌクレオソームがらせん状に規則正しく折りたたまれることによって直径約30ナノメートルの「クロマチン線維」を形成し、さらに、らせん状に巻かれて階層構造を作るとされていました( 図2 中段左)。この説は広く受け入れられてきましたが、国立遺伝学研究所・前島教授らは、2008年よりクライオ電子顕微鏡 やX線散乱 の実験によって、定説のような規則正しいクロマチン線維は存在せず、ヌクレオソームが不規則に細胞内に納められていることを提唱してきました( 図2 中段右)。それ以降、クロマチンの実体については、「生きた細胞」でのさらなる理解が求められてきましたが、その構造は数十から数百ナノメートルと非常に小さく、従来の光学顕微鏡を用いて観察することは困難でした。
図2 DNAの細胞内収納に関するこれまでの定説(中段左)と新しい説(中段右)。
本研究の成果
本研究では、ヌクレオソームの1個1個を観察できる超解像蛍光顕微鏡を構築することで、クロマチンの実体を「生きたままの細胞」で観察することを実現しました。その結果、クロマチン線維の代わりに、多数のヌクレオソームが不規則に折りたたまれることで形作られる直径約160ナノメートルのコンパクトな塊(クロマチンドメイン)が核内でダイナミックに動く様子を世界で初めて観察することに成功しました (図1) 。また、このようなクロマチンドメインの性質がどのようなメカニズムによって生み出されたのか調べたところ、ヌクレオソーム間の結合と、クロマチンを束ねるのに必要なコヒーシンタンパク質 の2つが重要であることがわかりました。さらに、クロマチンドメインは細胞分裂期の染色体でも観察されました。このことから、クロマチンドメインは遺伝情報の検索・読み出し・維持に重要な染色体ブロック(機能単位)であると考えられます (図3) 。
図3 (左)、細胞が分裂していないとき(間期)のクロマチンドメイン。ヌクレオソーム同士の結合とコヒーシンと呼ばれるリング状のタンパク質がドメインの維持に働いている。(右)分裂する際の染色体にもドメインが観察され、ドメインは染色体ブロック(機能単位)として働くと考えられる。
今後の期待
細胞の多くの活動は、DNA上の遺伝情報を検索するところから始まります。しかし、核内において遺伝情報を検索する際、探す領域が膨大だと効率が悪くなります。そこで、クロマチンドメインは、ブロックを形成することでタンパク質のアクセスを調節し、情報検索の制御・効率化に関わっていると考えられます。また、DNAの折りたたみがおかしくなると、細胞にガン化などのさまざまな異常をもたらすことが近年分かってきました。本研究の成果によって、このような細胞の異常や関連疾患の理解が進むことが期待されます。
研究体制と支援
本研究は、大阪大学産業科学研究所・永井健治教授、理化学研究所生命システム研究センター・岡田康志チームリーダー、米国 MBL・谷知己チームリーダー、高輝度光科学研究センター・城地保昌チームリーダー、国立遺伝学研究所・鐘巻将人教授、オランダエラスムス MC・Kerstin S. Wendtチームリーダー、慶應義塾大学・冨田勝教授、国立遺伝学研究所・野崎慎学振特別研究員、前島一博教授グループとの共同研究成果です。
文部科学省科学研究費補助金・新学術領域研究「少数性生物学」(領域代表:大阪大学 永井健治教授)、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST)「統合1 細胞解析のための革新的技術基盤」(研究総括:東京大学大学院 菅野純夫教授)(研究課題名「超解像3次元ライブイメージングによるゲノムDNAの構造、エピゲノム状態、転写因子動態の経時的計測と操作」(JPMJCR15G2)、研究代表者:岡田康志)、および科学研究費補助金(16H04746)の支援を受けました。
参考URL
大阪大学 産業科学研究所 生体分子機能科学研究分野
http://www.sanken.osaka-u.ac.jp/labs/bse/
用語説明
- 超解像蛍光顕微鏡
通常の光(可視光)を用いて顕微鏡観察する場合は、200ナノメートル程度の大きさのモノを解像するのが限界(光の回折限界)です。しかし、超解像蛍光顕微鏡はこの限界を超えて(超解像)、より小さな構造まで観察することができます。本研究では、クロマチンのヌクレオソームをまばらに蛍光標識することで超解像を達成するPALMという方法を用いました。
- ナノメートル
1メートルの10の9乗分の1(10 -9 )。
- クライオ電子顕微鏡
生きた状態に近い生物材料を観察することができる電子顕微鏡。「生きている」状態を保存するために、細胞を急速凍結し、凍結した細胞を極低温下(-150度)で薄く切り(切片化)、その切片を極低温下でそのまま観察する。
- X線散乱
タンパク質などが集まった構造体にX線を当てると、その構造体の規則性に応じた散乱パターンが得られる。このことを利用し、構造を調べる方法。理化学研究所SPring-8で強力なX線である放射光を用いて実験をおこなった。
- コヒーシンタンパク質
5つのタンパク質からなる巨大なリング状の複合体。そのリングの中に2本のヌクレオソーム線維を束ねると考えられている。姉妹染色体を束ねる役割も知られている。クロマチンを束ね、遺伝子の発現調節にも関与していると思われ、コーネリア・デ・ランゲ症候群やロバーツ症候群など、コヒーシン遺伝子の変異がヒトの遺伝疾患を引き起こすことが明らかになりつつある。
