コレラ菌が胆汁を目指して泳ぐしくみを解明!
世界を脅かす感染症:コレラの予防へ向けて
研究成果のポイント
・胆汁の成分であるタウリン にコレラ菌を誘引する作用があることを発見
・様々なアミノ酸を認識するセンサー蛋白質がタウリンを認識するしくみを原子レベルで解明
・センサーが誘引物質を認識する様子を生きたまま捉えることに世界で初めて成功
・コレラ菌の行動や制御の研究が格段に進むとともに、副作用の少ない新しいコンセプトの薬剤開発につながることに期待
リリース概要
大阪大学大学院理学研究科の今田勝巳教授・高橋洋平大学院生、法政大学生命科学部の川岸郁朗教授・西山宗一郎博士・山本健太郎大学院生、名古屋大学大学院理学研究科の本間道夫教授らの共同研究グループは、タウリンにコレラ菌を誘引する作用があることを発見し、そのしくみを原子レベルで明らかにしました。タウリンを認識していたのは様々なアミノ酸を認識するMlp37という蛋白質でした。X線構造解析から認識のしくみが明らかになり、蛍光分子 を使ってMlp37が誘引物質を認識する様子を捉えることにも成功しました。
本研究成果により、これまで誘引物質や忌避物質が結合したときの細菌の行動を直接観察することはできませんでしたが、蛍光による直接観察が可能になり、コレラ菌の行動や制御の研究が格段に進むと期待できます。また、副作用が少なく耐性菌のできにくい新しいコンセプトの薬剤開発につながる成果でもあります。
本研究成果は英科学誌Natureの姉妹誌「Scientific Reports」の電子版で2016年2月16日に公開されました。
研究の背景
コレラは現在も発展途上国を中心に流行している感染症であり、原因となるコレラ菌の感染・病原メカニズムの解明は予防のためにも重要です。コレラ菌は、河川や汽水域のような外界でも長く生き延びることができますが、そのような栄養の少ない環境下ではコロニー を作らず毒素も出しません。ところが、ヒトの小腸など栄養分が豊富に存在する環境になるとコロニーを形成して毒素を作り始め、激しい下痢を引き起こします。コレラ菌は胆汁に向かって泳ぐ性質があり、胆汁があるとコレラ菌はバイオフィルム を形成して定着します。コレラ菌が、胆汁が豊富にある小腸に留まって増殖するのは、この性質によると考えられています (図1) 。
図1 コレラ菌の生活環,及び人体内で胆汁に誘引されるコレラ菌の概念図
コレラ菌は河川や汽水域といった外界(低温・貧栄養)と人体内(高温・富栄養)という異なった環境を循環していると考えられています。ひとたび人体に入り込むと腸内に定着し,コレラ毒素をはじめとした様々な病原因子を作りはじめます。本研究によりコレラ菌が胆汁成分中のタウリンに引き寄せられることが明らかになりました。
このように、細菌は自分の居心地が良い環境を求めて移動したり、周囲の環境を感知して性質を変えたりします。このとき周囲の環境を感知するセンサーの役割を果たすのが走化性受容体と呼ばれる蛋白質で、いわば細菌の鼻や舌に相当します。コレラ菌には40種類を超える走化性受容体があることが知られています。しかし、そのほとんどの働きが今も分かっていません。従って、どの走化性受容体が胆汁のどの成分を感知するのかも不明でした。
手法と成果
共同研究グループは、胆汁の各成分に対するコレラ菌の応答を調べ、タウリンがコレラ菌を誘引することを発見しました。そこで、タウリンに応答するコレラ菌の走化性受容体を探したところ、Mlp37が働かない変異コレラ菌は、タウリンに走性を示さないことが分かりました。一般に、走化性受容体に誘引物質が結合すると受容体がメチル化 されます。コレラ菌をタウリン存在下に置くと、Mlp37がメチル化されました。さらに実際にタウリンがMlp37に結合することを、結合するときに発生する微弱な熱を検出するITCという手法で証明し、タウリンがMlp37で認識されることを明らかにしました。
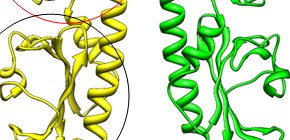
図2 Mlp37の分子構造
(A)解析したMlp37の構造。2つのMlp37分子(黄色と緑色)が2量体を形成する。赤で囲った領域と黒で囲った領域は似ているが、赤で囲った領域にのみ誘引物質が結合。
(B)セリンを結合したMlp37の赤で囲った領域の拡大図。Mlp37をピンク色で表示。セリンはボールで表示。
(C)タウリンを結合したMlp37の赤で囲った領域の拡大図。Mlp37を黄色で表示。タウリンはボールモデルで表示。タウリンはセリンと同じ場所に結合。
(D)セリンを結合したMlp37を分子モデルで表示。灰色のボールがセリン。Mlp37に隙間があるため(黒矢印)、外からセリンが見える。
(E)タウリンを結合したMlp37を分子モデルで表示。灰色と赤のボールがタウリン。Mlp37に隙間があるため(黒矢印)、外からタウリンが見える。
ところで、Mlp37はタウリンだけでなくセリンやアルギニンなど様々なアミノ酸も認識します。性質や構造の異なるアミノ酸やタウリンを同じひとつの蛋白質でなぜ認識できるのかは、Mlp37の不思議な部分でした。そこで、Mlp37の誘引物質を結合する領域を結晶化し、大型放射光施設SPring-8で収集したX線回折データを用いてタウリンおよびセリンと結合した状態の構造を原子レベルで解析しました (図2) 。その結果、誘引物質が結合できそうな場所が2カ所あるにもかかわらず、タウリンはセリンと同じ場所でセリンの形を真似るような配置で結合していました。また、Mlp37は各アミノ酸に共通する部分とはしっかり結合していますが、各アミノ酸で異なる側鎖の位置には隙間があり、この隙間のおかげでMlp37は様々な種類のアミノ酸を認識できることがわかりました。そこで、この隙間の外に蛍光物質がはみ出るような修飾を持つ蛍光アミノ酸を用いてコレラ菌の走化性応答を調べたところ、蛍光によってMlp37が誘引物質を結合する様子を捉えることに成功しました (図3) 。
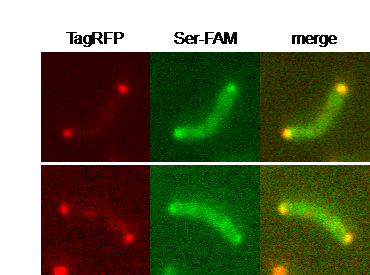
図3 Mlp37に蛍光修飾セリンが結合したコレラ菌
赤い蛍光を発するMlp37を作るコレラ菌に緑色の蛍光物質で修飾したセリンが結合する様子の顕微鏡写真。左は赤色に光るMlp37。中央は緑色に光る蛍光修飾セリン。右は左と中央を重ねたもので、Mlp37の位置で蛍光修飾セリンが光っており、Mlp37に蛍光修飾セリンが結合していることを示す。
本研究成果が社会に与える影響(本研究成果の意義)
コレラは、先進国での流行は見られなくなりましたが、WHOによると発展途上国では現在も毎年数百万人の患者が発生し、10万人以上が死亡する深刻な感染症です。コレラ菌は19世紀に発見され、人類に深刻な被害を与えてきたにもかかわらず、未だに分からないことが多い細菌です。今回の発見は、小腸内に留まり増殖するコレラ菌の行動がどのように制御されているか理解する上で非常に重要です。これまで誘引物質や忌避物質が結合したときの細菌の行動を直接観察することはできませんでしたが、蛍光による直接観察が可能になり、細菌の行動や制御の研究が格段に進むと期待できます。また、走化性受容体の働きを薬剤で制御することで、コレラ菌の行動や毒素産生を制御できる可能性があります。このような薬剤は細菌を死滅させることがないため、腸内の善玉菌を生かしたまま病原菌の病原性のみを奪うことができます。今回の成果は、副作用が少なく耐性菌のできにくい新しいコンセプトの薬剤開発につながる成果でもあります。
特記事項
本研究は、科研費および私立大学戦略的研究基盤形成支援事業の支援のもとに行われました。
また、本研究は大阪大学、法政大学、名古屋大学が共同で行ったものです。本件は、法政大学と名古屋大学においても同時にリリースされます。
掲載論文・雑誌
本研究成果は英科学誌Natureの姉妹誌「Scientific Reports」の電子版で2016年2月16日に公開されました。
論文タイトル:Identification of a Vibrio cholera chemoreceptor that senses taurine and amino acids as attractants.(タウリンとアミノ酸を誘引物質とするコレラ菌走化性受容体の同定)
掲載誌:Scientific Reports
著者:So-ichiro Nishiyama 1 , Yohei Takahashi 1 , Kentaro Yamamoto 1 , Daisuke Suzuki, Yasuaki Itoh, Kazumasa umita, Yumiko Uchida, Michio Homma, Katsumi Imada 2 , and Ikuro Kawagishi 2
1 同等の貢献度, 2 代表著者
参考URL
用語説明
- タウリン
胆汁に多く含まれるほか、心臓、肝臓、筋肉など体内の様々な場所に多く存在し、様々な生理作用を持つ物質。
- 蛍光分子
光のエネルギーを吸収して光を発する分子
- コロニー
細菌が増殖してできた塊
- バイオフィルム
細菌などの微生物の集団が自身の分泌する多糖類と入り交じってできる膜状の集合体。
- メチル化
分子の水素原子がメチル基に置き換わる化学反応
