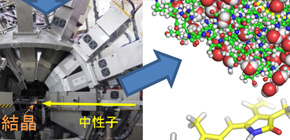
光合成色素を合成する酵素反応の瞬間を世界で初めて「水素原子レベル」の極小解析度で解明
光をエネルギーに変換する装置開発等への応用に期待
要点
・フィコシアノビリンという光合成色素を合成する酵素とフィコシアノビリンの材料となるビリベルジンという物質とが結合した構造を、東海村の大強度陽子加速器施設J-PARCにある「茨城県生命物質構造解析装置; iBIX」を使って、水素原子が見えるレベルの解像度で解析した。
・ビリベルジンに水素が一つ余分に付いた状態が混在していること、および その水素化部位、周囲のアミノ酸の水素化状態を解明し、水素原子の有無により、酵素反応がコントロールされることが分かった。また、これらの結果から初期段階の反応メカニズムの提唱に至った。
・エネルギーの高いX線の照射で発生する電子により、酵素の構造が本来と違う形に変化することが分かった。エネルギーが低い中性子の利用により、水素を可視化すること以外に、より天然状態に近い酵素の構造を解析することができる。
・光合成色素を合成する反応の秘密を解明したことにより、機能性色素の合成が容易になり、人工光合成などの装置開発に寄与することが期待できる。
概要
茨城大学大学院理工学研究科応用粒子線科学専攻・フロンティア応用原子科学研究センターの海野昌喜教授、大阪大学大学院工学研究科応用化学専攻の福山恵一招へい研究員(大阪大学名誉教授)、日本原子力研究開発機構原子力科学研究部門量子ビーム応用研究センターの玉田太郎研究主幹らのグループが、久留米大学、久留米工業高等専門学校、宮崎大学、(株)丸和栄養食品、茨城県との共同研究により、シアノバクテリア由来の光合成色素を合成する酵素PcyA とその基質 であるビリベルジン との複合体の中性子結晶構造解析 を行い、1.95Å分解能 で構造を解明した。
通常、タンパク質中の水素原子を可視化することは非常に難しいが、東海村のJ-PARC にある「茨城県生命物質構造解析装置; iBIX」 の利用で、水素を使って反応する酵素の反応直前の水素原子の配置を同定した。その結果、基質であるビリベルジンに通常の状態 (図1) と一つの水素が結合した状態の二つの状態があることが明らかになった。
それと共に、近くにあるアミノ酸の一つであるアスパラギン酸も二つの状態で存在する。また、ビリベルジン近傍にある二つのヒスチジンの間にヒドロニウムイオン(H 3 O + )が存在することが分かった。これらは、水素原子が見えたからこその初めての発見である。
さらに、ビリベルジン近傍の水の存在やグルタミン酸とビリベルジンとの相互作用様式など、X線結晶構造解析の結果とは異なる部位があった。これは、今まで、X線の還元力 により酵素が反応したものを観測していた可能性を示唆しており、「水素原子が見えやすい」という以外に、エネルギーが低い中性子の優位性を示す結果である。
研究の背景
シアノバクテリアや植物のような光合成生物は、細胞内にビリン色素と呼ばれる光を集める色素をもっています。そのビリン色素と結合したタンパク質のいくつかは、シアノバクテリアなどの中では光合成、高等植物の中では開花や紅葉・落葉などをコントロールするシグナル伝達の役割を担います。フィコシアノビリンはそのようなビリン色素の一つです。
本研究が対象としたPcyAと名付けられた酵素はビリベルジンという物質を還元してフィコシアノビリンの合成を助けます (図2) 。PcyAは、二個の電子と二個のプロトンを2回にわたって、ビリベルジンのD環、A環のビニル基それぞれに順番に渡し、還元反応を進めます。酵素が異なる二か所の反応を進めるのは非常に珍しく、どのように酵素がその反応を進めるのかということについて、多くの研究者が非常に興味を持っておりました。このような特別な反応は、その酵素の独特な構造(原子の配置)に制御されているため、構造を原子のレベルで調べることは、この謎を解明するために重要なことです。
PcyAのX線結晶構造解析により、PcyAの全体構造・ビリベルジンとPcyAの相互作用様式・光合成色素を合成するのに重要なアミノ酸が分かってきましたが、X線を用いて得られたPcyAの構造には、水素原子が見えませんでした。この反応のメカニズムを解明するために、本質的に重要な水素原子を可視化することが望まれていました。水素原子を見る最も有効な手段は中性子を使った構造解析です。今回、中性子解析により、PcyAがビリベルジンと結合している状態における水素原子の配置を解明しました。
研究の内容
これまでの研究で、ビリベルジンは、PcyAに結合すると二つの異なった状態になると言われていました。しかし、なぜ酵素に結合するとビリベルジンが二つの状態になるのか、ということは分かっていませんでした。また、ビリベルジン結合部位のアミノ酸だけでなく、その近くにある水分子の存在が、この反応に重要な役割を果たしているという説がありましたが、それを証明するためには水素原子を可視化しなければなりませんでした。
そこで、我々は、PcyAとビリベルジンの複合体の結晶を作製し、様々な条件を検討し、非常に大きな結晶にまで育てることを試みました。中性子結晶構造解析では、X線結晶構造解析では見えにくい水素原子を見ることが、理論的には比較的容易なのですが、一番の弱点は、中性子の強度が弱いため、結晶を大きくしなければならないことで、それが多くの研究者にとって、中性子結晶構造解析を遂行するための壁になっています。J-PARC の稼働とiBIXの検出器の高度化は、以前に比べるとその障壁を低くしたと言えます。
実験の概要
ビリベルジンが光を吸収する色素であるため、暗所でビリベルジンを扱わなければならないという苦労がありました。
まず、PcyAとビリベルジンの複合体の結晶を作製しました。結晶化する条件は、大阪大学と久留米大学のグループが確立した条件がありましたが、上述したように中性子結晶構造解析には、X線結晶構造解析で使われるものより体積比で1000倍以上の大きな結晶が必要なため、非常にたくさんの条件を試み、最終的に十分に大きな結晶を得ることに成功しました (図3) 。光をできるだけ避け、iBIX (図4) で中性子回折実験を行いました。慎重な構造解析の結果、概要に挙げたような重要な発見がありました。
成果のポイント
ビリベルジンには4個のピロール環があり、PcyAに結合すると、その3個に水素原子がある通常の状態 (図2) とそれに一つ余分に水素が結合した状態が混在すること、ならびにその余分の水素の結合部位を明らかにすることに世界で初めて成功しました (図5) 。ビリベルジンに結合しているアミノ酸の一つ「アスパラギン酸」にも水素が結合した状態と結合していない状態の二つの状態があり、ビリベルジンの状態に対応していました (図5) 。
また、ビリベルジン近傍にあるアミノ酸「ヒスチジン」はビリベルジンのある部位に水素を渡すのに有利な構造をしていることが分りました。さらに、そのヒスチジンとその隣にあるもう一つのヒスチジンの間にヒドロニウムイオン(H 3 O + )が存在していることを発見しました (図6) 。タンパク質のような大きな分子の中でH 3 O + を可視化することは、中性子構造解析が唯一の方法ではないかと思います。その他に、アスパラギン酸とは反対面に水分子があって、ビリベルジンと水素結合を形成していることも明らかにしました。
これらの発見から、フィコシアノビリンを合成する最初の段階のメカニズムを新しく提唱することに至りました。
もう一つ、重要な発見がありました。以前のX線結晶構造解析では、水素原子以外の構造が決定されていました。しかし、ビリベルジンの還元部位の近くにあるグルタミン酸との距離が通常の相互作用距離より短いことなど、奇妙な構造がありました。エネルギーの高いX線は、水分子と反応すると電子を発生させ、結晶内の物質を還元させてしまう可能性があります。今回、その奇妙な構造は、X線の還元力により生じた副産物であることが分かりました。この結果は、還元反応に敏感なタンパク質の構造解析を行う場合は、中性子解析の方がX線解析より、より正確な情報を与えることを示しています。
成果の波及効果
光合成色素の一つであるフィコシアノビリンは光合成や光センサーの心臓部になる物質です。これらが、どのようにPcyAにより合成されるかを解明していくことは、機能性色素を人工的に合成することを実現するために非常に重要です。PcyAのどの部分が重要なのかということが分かってきたので、その構造を模倣した分子を作れば、機能性色素が効率よく合成できるようになります。機能性色素を効率よく合成できるようになれば、この色素を組み込んだ人工光合成システムや光に応答するセンサーなどの構築が容易になり (図7) 、これからの新エネルギー転換に拍車をかけることができるかもしれません。
共同研究機関の役割
茨城大学は研究のほとんど全ての部分に携わりました。PcyAの精製、結晶化、重水素化、iBIX装置を用いた中性子回折実験、X線回折実験、構造解析、構造の解釈、X線照射の影響の解析、結晶の吸収スペクトル測定、論文の執筆です。
大阪大学では、X線結晶構造解析から、本研究の提案とデザインを主に行いました。
日本原子力研究開発機構は、結晶の大型化や中性子構造解析などを支援し、初期の中性子回折実験を行いました。
久留米大学、久留米工業高等専門学校、宮崎大学では、PcyAの反応解析、PcyAの構造機能相関についての考察などを行っていただきました。
(株)丸和栄養食品は、宇宙空間でのPcyA・ビリベルジン複合体の結晶化や放射光を使ったX線回折実験を行っていただきました。
海野昌喜教授のコメント
今まで、生物がどのようにフィコシアノビリンを合成するのか、その機構には謎が多かったのですが、iBIXを使った研究により、その反応の秘密の解明にかなり近づけたと感じています。フィコシアノビリンの原料となる色素とその近くのアミノ酸それぞれの水素の有無によって反応が制御されていることが分かりました。また、水分子(H 2 O)に水素イオン(プロトン; H + )が結合したヒドロニウムイオン(H 3 O + )の存在を見つけることができました。これは、H 3 O + の存在が反応を加速していることを示唆しています。さらに、X線を使って今まで分かっていた構造とは異なる部位も見つけました。この違いは、エネルギーの高いX線の照射が酵素に余分な反応を起こさせ、わずかに構造が変化してしまったためです。本研究においては、水素原子を観察するという目的以外にも、天然に近い構造を解析できる低エネルギーの中性子ならではの優位性を示すことができ、今後の研究に一石を投じることができたのではないかと思います。この研究の応用として、人工光合成のような新しいエネルギーシステムの開発が加速していくことが期待できます。
参考図
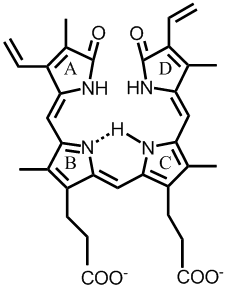
図1 ビリベルジン
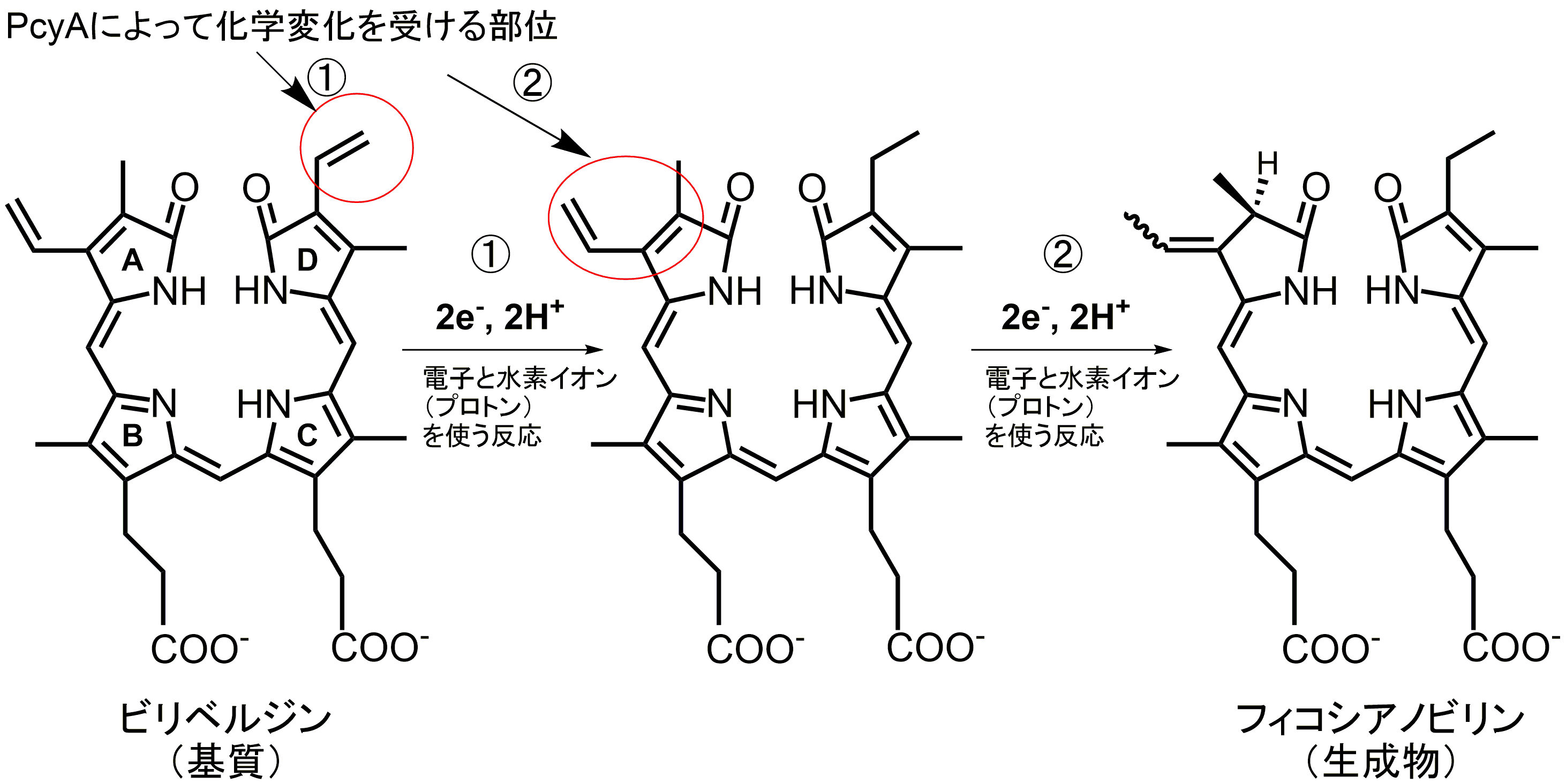
図2 PcyA(酵素)が行う光合成色素フィコシアノビリンの合成反応

図3 中性子結晶構造解析のための大型結晶を成長させることに成功

図4 茨城県生命物質構造解析装置iBIX
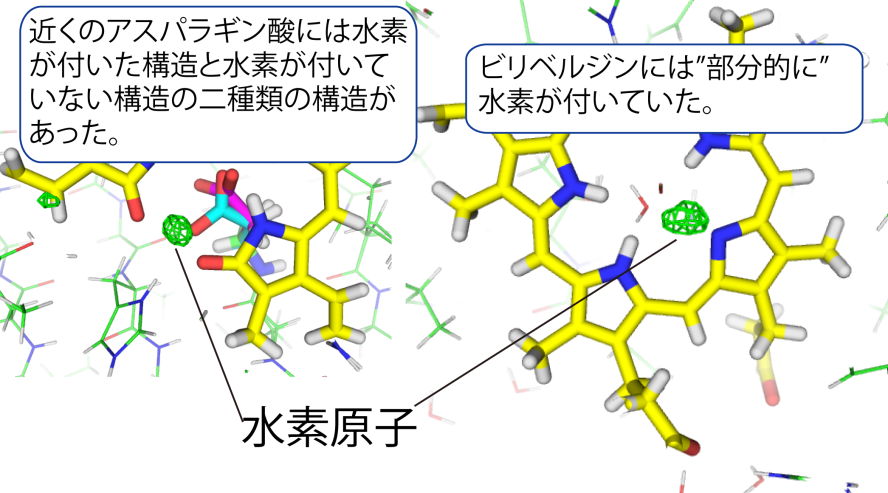
図5 ビリベルジンとアスパラギン酸の水素化状態
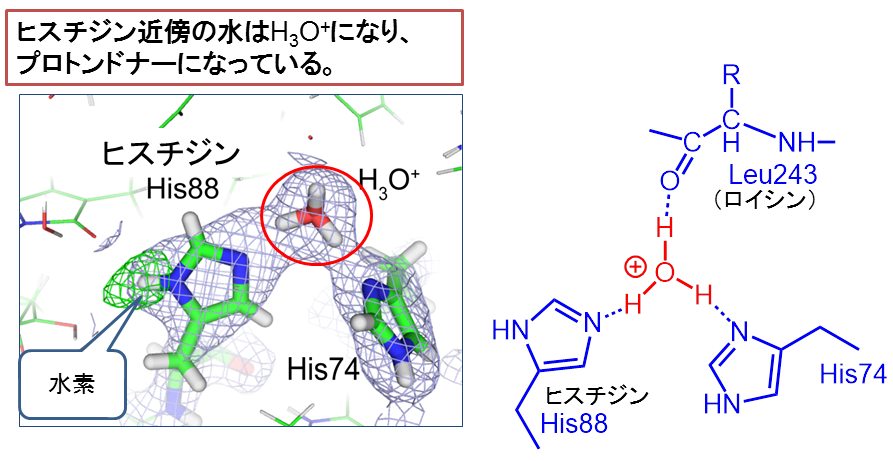
図6 ヒスチジンの水素化とヒドロニウムイオンの発見
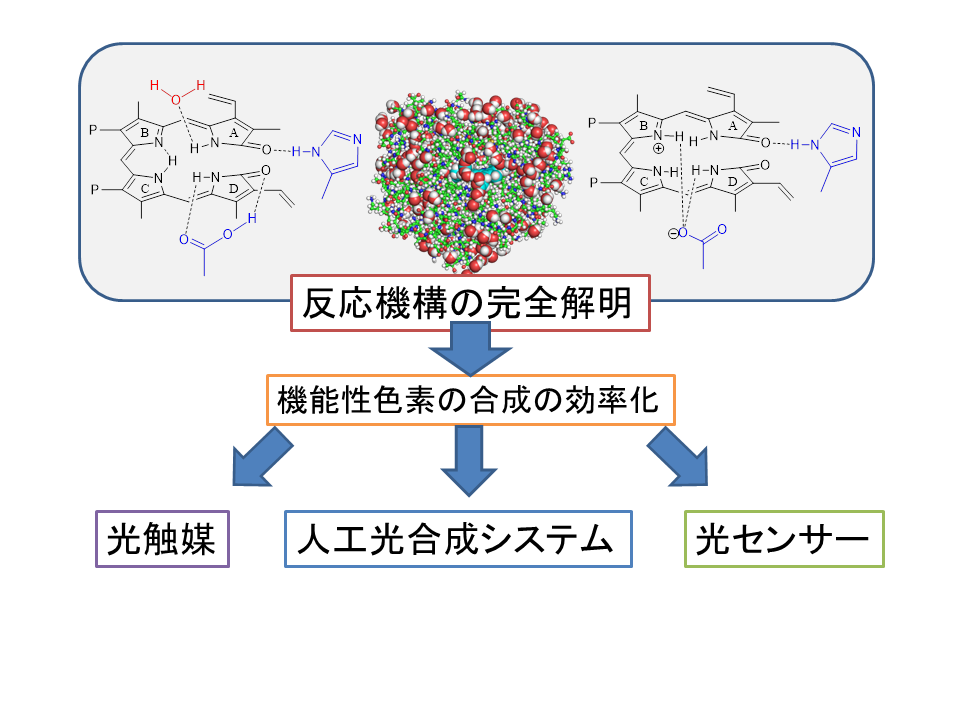
図7 本研究の波及効果
参考URL
用語説明
- ビリベルジン
4つのピロール環を持つ化合物 (図1) です。ヘモグロビンなどに含まれる、鉄-ポルフィリン錯体が分解されてできます。
- J-PARC
茨城県東海村にある大強度陽子加速器施設(Japan Proton Accelerator Research Complex)の略称です。陽子を加速して様々な粒子を発生します。 詳しくは http://j-parc.jp/public/about/about/index.html を参照してください。我々の研究では、加速した陽子が水銀に当たって発生する中性子を使っています。
- 茨城県生命物質構造解析装置; iBIX
茨城県生命物質構造解析装置( iBIX) :
茨城県がJ-PARCの物質・生命科学実験施設(MLF)に設置した2本の中性子ビームラインのうちの一つです。J-PARCの強力なパルス中性子源に対応して、最大限の成果が得られるように高感度の検出器を30台配置した世界初のパルス中性子源用単結晶中性子回折装置です。
- 酵素PcyA
酵素とは、タンパク質のカテゴリーの一つで、「化学反応を速やかに起こすために働く」タンパク質のことです。 PcyAはシアノバクテリアの一種の中の酵素タンパク質で、フィコシアノビリンという光合成色素を合成する酵素です。
- 基質
酵素が化学反応を行う対象のことを指します。基質を生成物に変える化学反応を助けるのが酵素です。PcyAの基質はビリベルジンであり、生成物がフィコシアノビリンです。
- 中性子結晶構造解析
物質の結晶に中性子を入射させて、結晶から散乱して来た中性子の強度分布を調べることにより立体構造を解析する方法です。 他方、X線結晶構造解析は、X線を入射することで物質の立体構造を解析する方法で、現在、タンパク質の立体構造を解析するのに最もよく使われている手法です。しかし、電子を一つしか持たない水素原子からの散乱強度が弱いため、タンパク質のような分子量が大きい物質の水素原子の位置まで決定することは非常に困難です。
- 分解能
一般的には“解像度”と同じような意味で用いられます。数値が小さいほど、細かい構造が正確に見分けられるということで、「分解能が高い」と表現されます。結晶構造解析の分野では、X線や中性子が結晶に当たって得られる回折像がいかに広い範囲で観測できるかで決まります。 Å(オングストローム)は、長さの単位で、1Å = 10 -10 mです。タンパク質中によく見られる炭素と炭素の共有結合(単結合)距離は、だいたい1.5Åです。
- X線の還元力
X線は電磁波なので、物質と相互作用すると、電子を発生します。電子は物質を還元しますから、X線を照射した場合、望まない還元反応が起こることがあります。
