細胞遊走を制御する蛋白質を同定!
動脈硬化や癌移転を阻止する新たなメカニズムを解明
研究のポイント
■AMPキナーゼ(AMPK)という酵素が活性化した状態においてのみリン酸化されるPdlim5という蛋白質を同定。
■Pdlim5中のアミノ酸の一部がリン酸化することで、網目状の膜形成を阻害することで、細胞遊走(細胞の移動運動)を抑制する。
■異常な細胞移動運動が寄与する病態(動脈硬化や癌転移)の改善に繋がることに期待。
概要
大阪大学大学院医学系研究科生化学・分子生物学講座(医化学)の塚本蔵助教らの研究グループは、AMPK 賦活化によりリン酸化 され、細胞移動運動を抑制する蛋白質Pdlim5を同定し、AMPK活性化による抗動脈硬化作用・抗癌作用の仕組みの一端を解明しました。AMPKによるPdlim5の177番目のセリンのリン酸化は、ラメリポディア形成 を阻害して細胞遊走(細胞の移動運動)を抑制します。今後、AMPK賦活化による動脈硬化の進行や、癌の進展・転移の抑制効果解明と臨床応用が期待されます (図1) 。
本研究成果は、2015年1月30日10時(英国時間)に英国科学誌「Nature Communications」で公開されました。
研究の背景
糖尿病による動脈硬化に伴う心血管合併症や癌は本邦における死亡原因の上位を占めますが、いずれも異常な細胞移動運動がその病態形成に関与します。興味深いことに、AMPK賦活作用を有する糖尿病治療薬は、心筋梗塞などの心血管系の病気の発生を抑制し、また、乳癌・子宮癌患者では術前化学療法の効果を高めることが臨床的に確認されています。
一見、異なるように思われる抗動脈硬化作用と抗癌作用を結びつける分子機構として有力視されているのがAMPK賦活化による細胞移動運動の抑制です。血管平滑筋細胞や癌細胞を含む多様な細胞にて、AMPK賦活化による細胞移動運動の抑制効果に関する多数の報告がありますが、その仕組みについては不明でした。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、AMPKのエネルギー代謝調節以外の新たな側面である細胞移動運動の調節機構が解明されました。今後、AMPK賦活化による抗動脈硬化効果や癌進展・転移抑制効果の解明と臨床応用が期待されます。
参考図
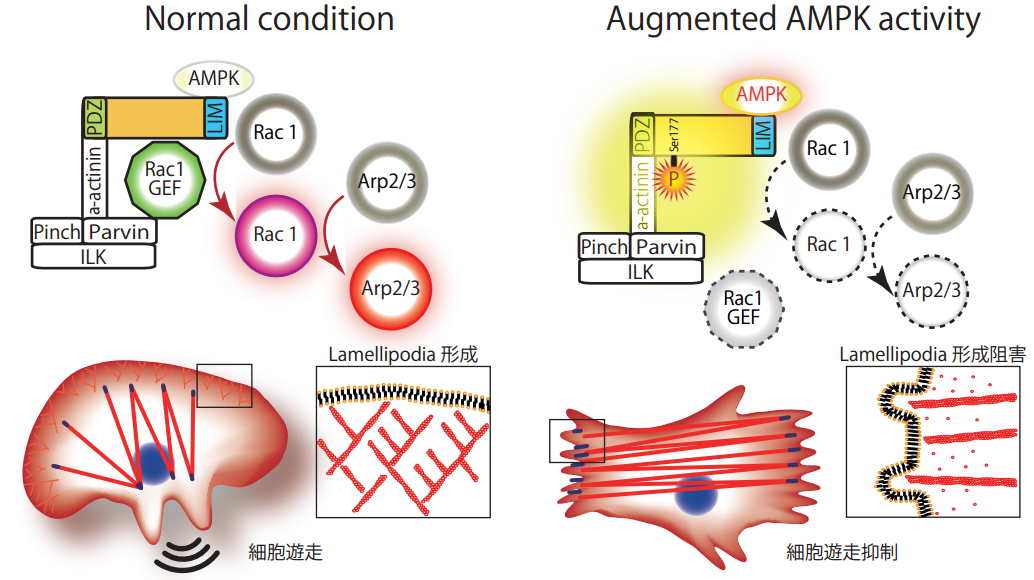
図1
通常の状態(Normal condition)では、移動運動する細胞の前方周辺縁にラメリポディア形成を促進する一連の蛋白質群(Rac1GEF, Rac1, Arp2/3)が活性化、ラメリポディアが形成され細胞が移動運動します。 一方、AMPK活性が増強した状態(Augmented AMPK activity)では AMPKによりPdlim5がリン酸化され、Pdlim5とRac1GEFとの結合が外れます。これにより細胞末梢での一連の蛋白質群の活性化が抑制され、ラメリポディア形成されず、細胞移動運動が抑制されます。
参考URL
用語説明
- AMPキナーゼ(AMPK)
細胞のエネルギー状態を感知し、エネルギー枯渇状態で活性化される酵素で、糖質、脂質、蛋白質代謝に関連する酵素群をリン酸化して、機能を調節します。
- リン酸化
蛋白質キナーゼの作用で、主に蛋白質にリン酸基が付加される化学反応。リン酸基が付加されることにより、リン酸化された蛋白質の機能が調節される。
- ラメリポディア
移動運動する細胞の前方周辺縁に形成される薄いアクチンフィラメント(膜状)の網目構造。細胞の運動に重要な役割を持ちます。
